Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
Observe o frasco da figura a seguir que contém uma solução aquosa de ácido sulfúrico (H2SO4) utilizada em laboratório, e responda, sabendo que o volume da solução contida no frasco é 2,0 L:
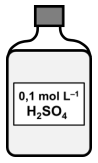
Qual o volume dessa solução necessário para obter
uma solução de 250 mL de H2SO4 com 0,025 mol L–1
?
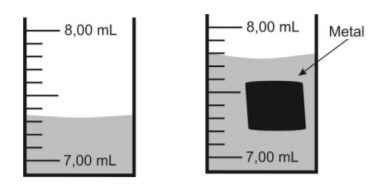
No experimento representado a seguir, um pedaço de metal foi adicionado a uma proveta graduada contendo água. Sabendo-se que a densidade deste metal é 10,49 g cm -3 , a massa do metal utilizada no experimento é
Sendo assim, o pH resultante desta mistura será:

Qual o teor de sólidos totais da amostra de maçã a partir dos dados acima?
Qual é o volume de solução 1 mol/L de H3BO3 que deve ser adicionado a 200 mL de solução de H3BO3 2,0% m/v para obter a solução desejada de H3BO3 4,0% m/v?
Dado: Massa molar H3BO3: 62,83 g/mol
Sabões são sais de sódio ou potássio de ácidos graxos, obtidos pela reação de gorduras e óleos (triglicerídeos) com NaOH, KOH ou Na2CO3. A reação de saponificação é representada a seguir:
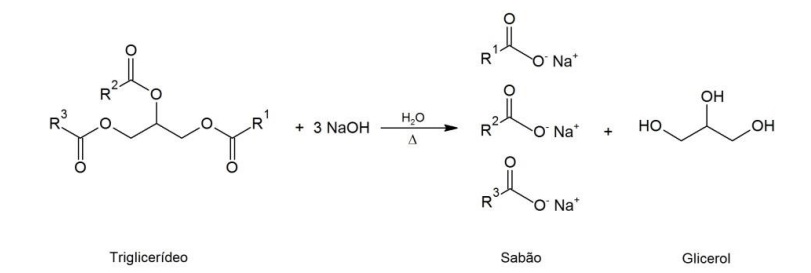
em que R1 , R2 e R3 são cadeias lineares saturadas ou insaturadas, geralmente com doze ou mais átomos de carbono.
Com base nessas informações, considere as seguintes afirmativas:
1. Uma solução aquosa de sabão puro apresenta pH < 7.
2. Adição de ácido forte a uma solução de sabão acarreta precipitação de ácidos graxos.
3. Ca(OH)2 não pode ser usado na obtenção de sabão, pois sais de cálcio de ácidos graxos são insolúveis em água.
4. A obtenção de sabão com Na2CO3 segue a mesma estequiometria que no uso do NaOH.
Assinale a alternativa correta.
A utilização de conversores catalíticos no escapamento de automóveis diminui a emissão de gases tóxicos que são também geradores de compostos ácidos, como indicado nas seguintes equações:
2CO + 2NO → 2CO2 + N2
2CO + O2 → 2CO2
2NO → N2 + O2
Em um teste de laboratório, foram colocadas em um reator inextensível quantidades estequiométricas de CO, NO, O2 e
catalisador. Considerando que o experimento foi realizado nas CNTP, que os reagentes e os produtos são gases ideais e
que a conversão foi de 100%, qual será a pressão final do sistema, em atm?
Foi requisitado a um técnico de laboratório que preparasse uma solução de hidróxido de amônio, a partir de uma solução comercial concentrada, cujo rótulo contém as informações ao lado:
Dados: MM(NH3) = 17g/mol
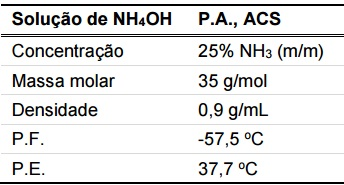
Assinale a alternativa que indica o volume aproximado da solução
comercial (em mL) que o técnico deve utilizar para obter 5 litros de
uma solução de NH4OH 1 mol/L.
Na determinação de cálcio em águas naturais, a AOAC (Association of Official Analytical Chemists/USA) recomenda um método gravimétrico que consiste em adicionar excesso de ácido oxálico (C2H2O4) a um volume conhecido de amostra e, em seguida, adicionar a quantidade necessária de NH4OH. O precipitado obtido é filtrado, seco, calcinado e pesado, e a massa de CaO obtida é utilizada para calcular a quantidade de Ca na amostra que, segundo a norma da AOAC, deve ser expressa como teor de carbonato de cálcio. O método citado é ilustrado pelas equações a seguir. Na análise de uma amostra de 100,00 mL de água, a massa de CaO obtida foi de 0,2800 g.
Ca+2(aq.) + C2O4 -2 (aq.) → CaC2O4(s)
CaC2O4(s) → CaO(s) + CO + CO2
Dados: Massas molares aproximadas: MM(C2H2O4.2H2O) = 126 g/mol; MM(CaO) = 56 g/mol; MM(CO2) = 44 g/mol, MM(CaCO3) = 100 g/mol; densidade (H2O) = 1,0 kg/L.
De acordo com os dados apresentados, qual é a concentração de cálcio na amostra de água analisada, expressa em ppm
de CaCO3?
A morfina é um derivado do ópio, utilizado desde o século XIX como anestésico em campos de batalha e graves doenças terminais. O derivado mais famoso desse alcaloide é a heroína, obtida pela acetilação da morfina com anidrido acético, como ilustrado pela seguinte reação não balanceada:
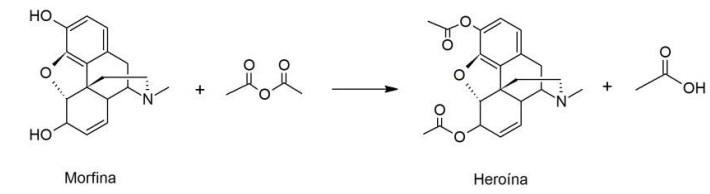
De acordo com a reação acima, quantos mols de anidrido acético são necessários para acetilar totalmente 2 mols de
morfina?
Artefatos de aço inoxidável são resistentes à corrosão devido a um fenômeno conhecido como passivação, que é a formação de uma fina camada de óxido de cromo na superfície, por ação do ar ou de oxidantes químicos. Sabendo-se que o ácido nítrico (HNO3) na concentração de 1,6 mol/L pode ser usado como agente passivante, qual volume de HNO3 concentrado (em litros) deve ser utilizado para a obtenção de 100 L de solução passivante?
(Dados: MM(HNO3) = 63,0 g/mol; HNO3 concentrado: d = 1,40 g/mL; teor máximo = 65%(m/m))
Pode-se considerar que o processo Rasching de produção de hidrazina (N2H4), que envolve a oxidação de amônia, ocorre em três etapas consecutivas, representadas pelas equações químicas não balanceadas na sequência abaixo:
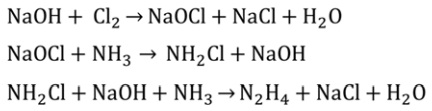
Assim, o número de mol de amônia necessários para a produção de dois mol de hidrazina é
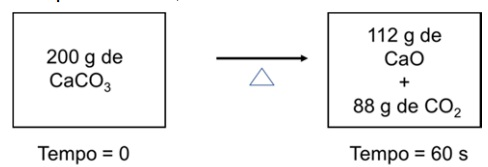
O acúmulo total de massa, em gramas, para a decomposição térmica do carbonato de cálcio em um sistema fechado, representado pelo esquema abaixo, é