Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
Observe a figura para responder à questão.

Que volume (mL) é necessário da solução concentrada do rótulo (HNO3) no preparo de 250 mL de uma solução de 0,5 M?
Dados
densidade 1,4 g/mL; massa molecular
63g/mol; pureza 65%
Um método simples de se reduzir a concentração de íons prata (Ag+ ) livres em solução aquosa é através da adição de amônia (NH3 ) a mesma, resultando na formação do complexo Ag(NH3 )2 + , cuja constante de formação (kf ) é igual a 1,7 x 107 , a 25ºC. Indique qual a concentração de Ag+ presente em uma solução em equilíbrio quando amônia concentrada é adicionada a solução de AgNO3 0,010 mol L-1 para fornecer uma concentração de amônia no equilíbrio de 0,20 mol L-1 .
Desprezar a variação de volume causada pela adição de NH3 .
A reação química 2H2(g) + 2NO(g) 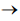 N2(g) + 2H2O(g) ocorre em duas etapas:
N2(g) + 2H2O(g) ocorre em duas etapas:
etapa 1: H2(g) + NO(g) + NO(g) 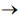 N2O(g) + H2O(g)
N2O(g) + H2O(g)
etapa 2: H2(g) + N2O(g) 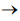 N2(g) + H2O(g)
N2(g) + H2O(g)
Sobre essas reações químicas, é CORRETO afirmar que na etapa
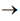 (NH4)3H4P(Mo2O7)6 + H2O
A soma dos coeficientes estequiométricos dessa equação química, após o correto balanceamento, é igual a
(NH4)3H4P(Mo2O7)6 + H2O
A soma dos coeficientes estequiométricos dessa equação química, após o correto balanceamento, é igual a C8H18(
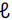 ) + O2(g) → CÜ2(g) + H2O(v)
) + O2(g) → CÜ2(g) + H2O(v)
Considere que após uma hora e meia de reação foram produzidos 72 mols de CO2. Dessa forma, a velocidade de reação, expressa em número de mols de gasolina consumida por minuto, é de:
2Fe(s) + O2(g) + 2H2O → 2Fe(OH)2(s)
Com base nas informações acima, é possível afirmar que:
 , no qual não havia sua
concentração registrada. Para verificar a concentração dessa solução, transferiu uma alíquota de 2,00 mL da
mesma para um balão volumétrico de 25,0 mL, completando o restante com água. Em seguida, foram
transferidos 10,0 mL da solução diluída para um erlenmeyer para proceder à titulação. O volume de NaOH,
0,100 mol.L-1, gasto na titulação foi de 20,0 mL. Qual a concentração da solução de HC
, no qual não havia sua
concentração registrada. Para verificar a concentração dessa solução, transferiu uma alíquota de 2,00 mL da
mesma para um balão volumétrico de 25,0 mL, completando o restante com água. Em seguida, foram
transferidos 10,0 mL da solução diluída para um erlenmeyer para proceder à titulação. O volume de NaOH,
0,100 mol.L-1, gasto na titulação foi de 20,0 mL. Qual a concentração da solução de HC encontrada no
laboratório?
encontrada no
laboratório?