Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de
109 kcal.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, a quantidade de O2 consumida é de
48 g.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g.
Um Profissional Técnico de Laboratório precisava determinar o teor de cinzas de uma amostra de biodiesel e seguiu uma metodologia descrita por Araújo et al, 2008. Para isso, ele utilizou cadinhos previamente tarados via aquecimento em mufla e pesagem. Nos cadinhos foram adicionados uma determinada quantidade de biodiesel. A seguir, a amostra foi submetida a aquecimento até a temperatura de combustão e após a queima foi aquecida a uma temperatura de 800°C por 2 horas. Em seguida foi adicionada uma solução aquosa de ácido sulfúrico (1:1) e a amostra foi novamente submetida ao processo de aquecimento (800°C por 2 horas). O Profissional Técnico aguardou o resfriamento e efetuou a pesagem dos cadinhos. O procedimento de aquecimento foi repetido até observação de peso constante.
ARAÚJO, A. M. M.; EVANGELISTA, J. P. C.; GOMES, A. F.; SOUZA, L. D.; MATIAS, L.G. O. Análises das cinzas sulfatadas do biodiesel produzido a partir da matéria-prima extraída do RN. In: 48º Congresso Brasileiro de Química – Química na Proteção ao Meio Ambiente e à Saúde. Rio de Janeiro, 2008.
Acerca da situação hipotética descrita acima,
assinale a alternativa correta.
Em uma determinação de cálcio por fotometria de chama, uma amostra de água mineral foi diretamente analisada, sendo obtido o teor de cálcio igual a 15,81 mg.L–1 . A mesma amostra foi, posteriormente, contaminada com lantânio a 1% e então submetida à análise nas mesmas condições. O teor de cálcio obtido na segunda determinação foi 58,97 mg.L–1 .
O teor de cálcio na amostra foi de
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Para a reação:
H2(g) + CO2(g) ↔ H2O(g) + CO(g)a 700°C, a constante de equilíbrio para concentrações Kc = 0,534. Calcule o número
de mols de H2(g) presentes no equilíbrio, se uma mistura de 0,300 mol de
CO(g) e 0,300 mol de H2O(g) for aquecida a 700°C em um recipiente de 10,0 L.
O alumínio reage de forma bastante energética quando colocado em solução aquosa concentrada de NaOH, produzindo um precipitado, o tetrahidroxialuminato de sódio, e gás hidrogênio, conforme se explicita na equação química a seguir.
2 Aℓ (s) + 2 NaOH (aq) + 6 H2 O (l) → 2 NaAℓ(OH)4 (s) + 3 H2 (g)
O rendimento percentual da reação é de 90%. A partir de 81,0 g de alumínio em pó, adicionado em meio aquoso onde se garante excesso de NaOH, o volume de gás, em litros, produzido (considerando-se 1 atm de pressão, a 298 K e comportamento ideal) é mais próximo de
Dado
M (H2 ) = 2 g mol-1
M (Aℓ) = 27 g mol-1
R = 0,082 atm L mol-1 K-1
R × T = 24,4 atm L mol-1
O minério magnetita é formado pelo seguinte processo:
3FeO (s) + CO2 (s) à Fe3O4 (s) + CO (g)
Quantos mols, aproximadamente, de dióxido de carbono são necessários para reagir com 750 g de óxido de ferro(II)?
Dados:
(massa molar do FeO = 71 g/mol; massa
molar do CO2 = 44 g/mol)
A seguir é mostrada a equação da reação entre cloro e estireno.
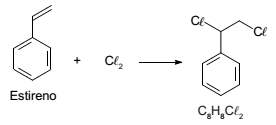
Sobre a reação, seus reagentes e o produto listam-se abaixo três afirmativas:
I - Os átomos de cloro no produto estão na configuração cis.
II - Em relação ao estireno, o produto clorado tem maior massa molar.
III - O estireno é um hidrocarboneto alifático.
Está correto APENAS o que se afirma em
A acetanilida é uma amida secundária, que tem a mesma função do paracetamol, atuando como analgésico e antipirético. Pode ser sintetizada por meio de uma reação da anilina, como apresentado na reação a seguir:

Em um laboratório, a reação apresentada foi conduzida nas condições de temperatura e
pressão apropriadas, com a adição de 279 kg de anilina e 204 kg de anidrido acético, ambos
com pureza de 100%, em um reator. A reação alcançou rendimento de 80%.
A acetanilida é uma amida secundária, que tem a mesma função do paracetamol, atuando como analgésico e antipirético. Pode ser sintetizada por meio de uma reação da anilina, como apresentado na reação a seguir:

Em um laboratório, a reação apresentada foi conduzida nas condições de temperatura e
pressão apropriadas, com a adição de 279 kg de anilina e 204 kg de anidrido acético, ambos
com pureza de 100%, em um reator. A reação alcançou rendimento de 80%.
Uma amostra de minério (5,00 g) foi completamente dissolvida em ácido e o volume ajustado para 100,00 mL. Uma alíquota de 10,00 mL dessa solução aquosa foi misturada, de forma lenta e sob agitação constante, com excesso de solução aquosa de hidróxido de amônio, suficiente para promover a precipitação completa de ferro na forma de Fe(OH)3 .
Fe3+ (aq) + 3OH- (aq) → Fe(OH)3 (s)
Após envelhecer, em sua água mãe, filtrar e lavar, o precipitado foi calcinado em forno mufla para formar Fe2O3 , que depois foi deixado para resfriar, em dessecador, até massa constante.
2 Fe(OH)3(s) → Fe2O3(s) + 3H2O(g)
Sendo a massa de Fe2O3(s), obtida após a calcinação, igual a 3,84 g, o valor mais próximo da percentagem (massa/ massa) de ferro no minério é
Dado
M (Fe) = 56 g mol-1
M (Fe2O3
) = 160 g mol-1
O nióbio é um elemento usado para produção de aços com propriedades especiais. Na natureza, ele ocorre na forma de pentóxido de nióbio, de onde se pode obter o nióbio metálico por um processo térmico, usando uma mistura de alumínio e óxido de ferro (III), como mostrado na equação química a seguir.
3 Nb2O5(s) + Fe2O3(s) + 12 Al(s) → 6 Nb(s) + 2 Fe(s) + 6 Al2O3(s)
O processo térmico em questão produz o nióbio metálico com rendimento de 80%.
O valor aproximado da massa de Nb, em tonelada, que seria obtida a partir de 1,6 toneladas de Nb2O5 é
Dados
M (Nb) = 93 g mol-1
M (Nb2O5
) = 266 g mol-1
