Questões de Concurso Comentadas sobre química
Foram encontradas 7.347 questões
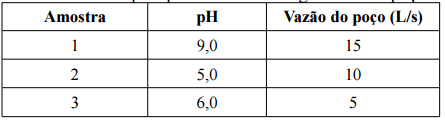
Sendo assim, o pH resultante desta mistura será:
As atividades realizadas nos laboratórios didáticos de Química precisam ser acompanhadas do descarte correto dos resíduos produzidos durante as aulas experimentais, sendo importante classificar os resíduos e escolher o tratamento mais adequado. Nesse sentido, numere a coluna da direita de acordo com sua correspondência com a coluna da esquerda.
1. Resíduos básicos concentrados, p. ex. aminas. / ( ) Tratar com sulfito de sódio e depois ajustar o pH entre 7 e 9.
2. Resíduos fortemente oxidantes em solução, p. ex. permanganato. / ( ) Recobrir o resíduo com enxofre em pó e armazenar.
3. Resíduo de mercúrio metálico. / ( ) Diluir até obtenção de uma solução com pelo menos 50% de água (em volume) e, em seguida, ajustar o pH entre 7 e 9.
4. Resíduo contendo sais de cianeto em solução aquosa diluída. / ( ) Adicionar 1 grama de NaOH por 100 mL de solução. Adicionar água sanitária.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
Sabões são sais de sódio ou potássio de ácidos graxos, obtidos pela reação de gorduras e óleos (triglicerídeos) com NaOH, KOH ou Na2CO3. A reação de saponificação é representada a seguir:
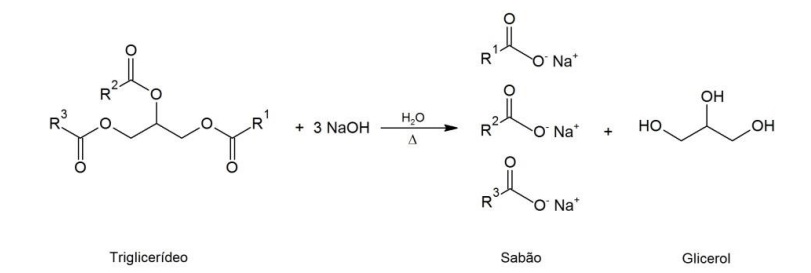
em que R1 , R2 e R3 são cadeias lineares saturadas ou insaturadas, geralmente com doze ou mais átomos de carbono.
Com base nessas informações, considere as seguintes afirmativas:
1. Uma solução aquosa de sabão puro apresenta pH < 7.
2. Adição de ácido forte a uma solução de sabão acarreta precipitação de ácidos graxos.
3. Ca(OH)2 não pode ser usado na obtenção de sabão, pois sais de cálcio de ácidos graxos são insolúveis em água.
4. A obtenção de sabão com Na2CO3 segue a mesma estequiometria que no uso do NaOH.
Assinale a alternativa correta.
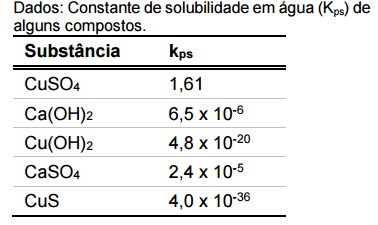
A calda bordalesa, muito utilizada como fungicida na agricultura, é preparada pela mistura de sulfato de cobre pentaidratado (CuSO4.5H2O), um pequeno excesso de cal (CaO) e água em proporção de 1:1:10 (m:m:v), respectivamente, obtendo-se uma suspensão muito fina (partículas pequenas).
De acordo com os dados de constante de solubilidade, assinale a alternativa que apresenta o constituinte principal do sólido suspenso na calda bordalesa.
Compostos fenólicos são utilizados como antioxidantes em alimentos, cosméticos e combustíveis, porém seu uso pode ser limitado pela solubilidade dessas substâncias nos produtos de aplicação. As estruturas de alguns antioxidantes fenólicos mais usados são mostradas ao lado:
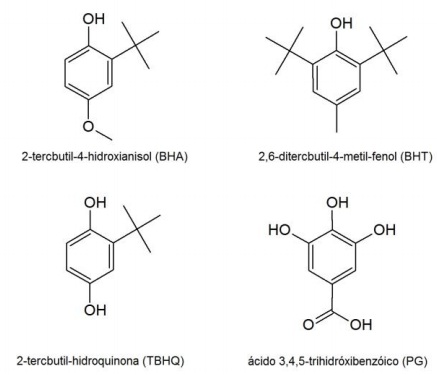
Em relação à polaridade das substâncias apresentadas,
assinale a alternativa que apresenta a ordem crescente de
solubilidade desses compostos em óleos vegetais
(triglicerídeos).
Alguns processos de obtenção de H2SO4 utilizam pirita (FeS2) como matéria-prima no lugar de enxofre elementar (S8). Esses processos podem ser descritos resumidamente pelas seguintes equações, nas quais se pode notar variações no estado de oxidação do enxofre:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
De acordo com o texto, assinale a alternativa que apresenta os estados de oxidação do enxofre nas espécies FeS2, SO2,
SO3 e H2SO4, respectivamente.
Adicionaram-se lentamente 5,0 mL de ácido sulfúrico concentrado (pureza 0,98% m/m) em 100 mL de água destilada e completou-se, com água destilada, até o volume de 500 mL. A normalidade da solução resultante é, aproximadamente,
Dados para o H2SO4:
Massa molar = 98 g mol-1.
Densidade = 1,84 g mL-1.
Abaixo estão listados cinco compostos:
1. Sílica gel
2. Alumina
3. Terra diatomácea
4. Poliamida
5. Celulose
Dentre esses compostos, pode(m) ser utilizado(s) como adsorvente(s) para cromatografia em camada delgada