Questões de Concurso Sobre química
Foram encontradas 14.919 questões
I.A água pesada (D2O) é uma forma de água onde os átomos de hidrogênio são substituídos por deuterium, um isótopo do hidrogênio.
II.A densidade do gelo de D2O é quase idêntica à densidade da água líquida de D2O.
III.O ponto de fusão do gelo de água pesada (D2O) é maior que o do gelo de água comum (H2O).
É correto o que se afirma em:
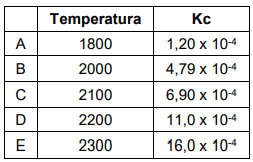
Diante dos valores acima, assinale a alternativa que apresenta maior concentração de monóxido de nitrogênio.
( ) A lei de velocidade é a equação matemática que exprime como as concentrações interferem na velocidade de uma reação a uma determinada temperatura.
( ) Só é possível determinarmos a ordem de uma reação somando os expoentes a que se devem elevar as concentrações dos reagentes exclusivamente para se obter a lei de velocidade de reação.
( ) Molecularidade é o número de moléculas que se chocam em cada etapa da reação.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
(Dados: C=12; H=1; O=16)
Assinale a alternativa que corresponde a reação de combustão do propano e a velocidade desta reação.
I. 2 MnO₂(s) + H₂O(ℓ) + 2 e⁻ → Mn₂O₃(s) + 2 OH⁻(aq)
II. Zn(s) + 2 OH- (aq) → ZnO(s) + H₂O(ℓ) + 2 e⁻
I. Os químicos admitem que, ao se chocarem, as moléculas transformam parte de sua energia cinética em potencial, adquirindo, o conjunto resultante do choque, alta energia potencial. Este conjunto forma um composto intermediário, chamado complexo ativado.
II. O complexo ativado representa um estado instável que se chama estado de transição. Esse estado de transição comum à reação direta e à inversa.
III. Ao romper-se, o complexo pode tanto ocasionar a formação dos produtos como a recuperação dos reagentes. Em outras palavras, só conseguem formar o complexo ativado as moléculas com energia cinética mínima necessária que se choquem adequadamente.
Estão corretas as afirmativas:
Considerando a formação do metano, a partir da reação:
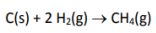
Assinale a alternativa que apresenta qual seria a quantidade em quilocalorias, em valor absoluto, envolvido na formação de 1 mol de metano dadas as seguintes variações de entalpia de combustão:
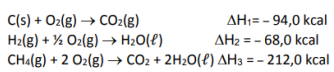
Assinale a alternativa correta.
I. 2 MnO2(s) + H2O(ℓ) + 2 e⁻ → Mn2O3(s) + 2 OH⁻(aq)
II. Zn(s) + 2 OH- (aq) → ZnO(s) + H2O(ℓ) + 2 e⁻
As pilhas alcalinas começaram a ser produzidas no Brasil em 1978. A diferença básica entre essa pilha e a de Zn-C é que a primeira emprega célula eletroquímica com materiais ativos de maior grau de pureza. As pilhas alcalinas são mais resistentes a altas temperaturas, oferecem maior segurança contra vazamentos e duram de quatro a dez vezes mais que as Zn-C dependendo do uso. (https://www.scielo.br acesso em 16/04/2023)
Entre as vantagens dessa nova pilha está o fato de não ocorrer a formação de gases durante o processo redox, eliminando-se, portanto, os riscos de explosões. Sabendo-se que o potencial padrão de redução, E°, do zinco e do manganês, nos processos I e II, é -1,25 V e + 0,29 V, respectivamente, calcule a voltagem produzida pela pilha.
2HCl (aq) + CaCO3 (s) → CaCl2 (aq) + H2O (l) + CO2 (g)
Pensando nas condições normais de temperatura e pressão (CNTP), vamos calcular a massa de água, em gramas, e o volume de gás carbônico, que pode se formar a partir de 80g de carbonato de cálcio. Dados as massas atômicas de Ca= 40; C = 12; O=16. Assinale a alternativa que apresenta os valores encontrados.
O Regulamento Técnico SVS/MS nº 540/1997 considera o fermento químico como um aditivo, e como tal, necessita obrigatoriamente ser registrado na ANVISA de acordo com as orientações da Resolução nº 23 (ANVISA, 2000).
Basicamente, os fermentos químicos são constituídos de uma mistura de pirofosfato ácido de sódio, bicarbonato de sódio e fécula de mandioca. Além do conhecido bicarbonato de sódio, assinale a alternativa que apresente alguns ácidos que podem fazer parte da composição.
“Apesar dos conceitos básicos de acidez e da capacidade de troca de cátions (CTC) serem bastantes conhecidos, tanto nas regiões de clima temperado como nas regiões de clima tropical, ainda existe muita confusão gerada pelo uso inadequado destes conceitos na solução de problemas ligados à fertilidade do solo”. (CAMARGOS, 2005)
Diante do exposto, analise as afirmativas abaixo.
I. Acidez ativa é dada pela concentração de H+ livre na solução do solo, que é liberada pelas substâncias que compõem a acidez potencial e é medida pelo valor de pH, em escala que, para a maioria dos solos do Brasil, varia de 4,0 a 7,5.
II. A acidez ativa é muito fácil de ser corrigida, pois em 1 ha com pH = 4,0, com 25% de água, precisa apenas de 2,5 kg de CaCO3 para ser corrigido. Porém, à medida que se neutraliza o H+ em solução, as substâncias que compõem a acidez potencial passam a liberar mais H+ que tende a manter, ao final de reações no solo, altos índices de acidez ativa.
Assinale a alternativa correta.
I. As ligações químicas nos compostos orgânicos podem ser do tipo s ou p . A ligação s é formada pela interação de dois orbitais atômicos, segundo o eixo que une os dois átomos, ao passo que na ligação p, a interação dos orbitais atômicos se faz segundo o plano que contém o eixo da ligação.
II Neste composto orgânico podemos encontrar 2 ligações s e 6 ligações p.
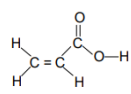
III. Neste composto orgânico podemos encontrar 3 ligações s e 6 ligações p.
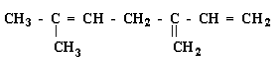
Estão corretas as afirmativas:
( ) É um tipo particular de ligação entre moléculas que possuem átomos de hidrogênio ligados a átomos de flúor, oxigênio ou nitrogênio.
( ) Nas pontes de hidrogênio, os elementos são muito eletronegativos e possuem pequenos raios atômicos, neste caso, fazendo com que o par de elétrons fique muito atraído pelo elemento mais eletronegativo, gerando dipolos (+) e (-) bastante intensos.
( ) As moléculas H2O ; NH3 ; HF são exemplos de ligações com formação de pontes de hidrogênio.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
I. Sabemos que as moléculas polares são aquelas que têm regiões ou polos de carga elétricas diferentes. Isto pode ser explicado pela diferença de eletronegatividade entre os ligantes. Costuma-se afirmar que as moléculas assimétricas são polares e que as moléculas simétricas são apolares, quando se refere justamente a de densidade eletrônica.
PORQUE
II. Elementos diferentes têm, geralmente, eletronegatividades diferentes, com isso, haverá regiões de densidades eletrônicas diferentes que não serão compensadas umas pelas outras.
Assinale a alternativa correta.
Em relação aos elementos químicos mencionados anteriormente, analise as afirmativas abaixo. ]
I. Os ametais citados pertencem ao grupo dos calcogênios e ao grupo dos halogênios, possuindo seis e sete elétrons no subnível mais energético respectivamente.
II. Todos os metais citados pertencem ao quarto período da classificação periódica e possuem elétrons distribuídos em quatro camadas eletrônicas.
III. Existem na relação acima dois ametais que apresentam propriedades semelhantes às do oxigênio, pois possuem o mesmo número de elétrons na camada de valência.
IV. Todos os metais citados são elementos de transição e apresentam na camada de valência elétrons distribuídos no subnível d.
Estão corretas as afirmativas:
I. Alta temperatura de fusão e ebulição.
II. Boa condutividade elétrica em solução aquosa.
III. Mau condutor de eletricidade no estado sólido.
IV. Com exceção do grafite, não conduzem corrente elétrica, se encontrados puros.
Estão corretas as afirmativas: