Questões de Química - Sistemas Heterogêneos: Produto de Solubilidade (Kps). para Concurso
Foram encontradas 90 questões
A química ácido / base de muitos sistemas aquáticos naturais, incluindo rios e lagos, é dominada pela interação do íon carbonato, CO3 2-, uma base moderadamente forte, com ácido carbônico (H2 CO3 ), que é um ácido fraco. O ácido carbônico resulta da dissolução na água do gás carbônico e da decomposição da matéria orgânica na água. A fonte predominante de íon carbonato são as rochas calcárias, que são constituídas em grande medida por carbonato de cálcio (CaCO3 ). Embora esse sal seja quase insolúvel, uma pequena quantidade dele dissolve-se quando em contato com a água:
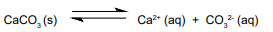
Considere que, em certa condição de temperatura do meio, a constante do produto de solubilidade (Kps) para o CaCO3 seja igual a 4 x 10–10. Nessas condições, qual é a massa de íon cálcio, em miligramas, dissolvida em 100 litros de solução?
Dado: massa atômica do cálcio = 40 u
Observe abaixo a representação do equilíbrio e da curva de solubilidade (em pmol/L) de um sal hipotético XY:
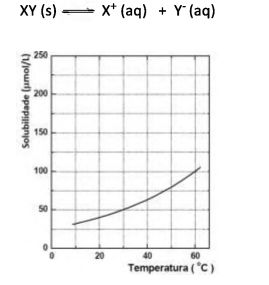
Qual é a constante do equilíbrio de solubilidade (Kps) do sal XY em 60 ºC?
