Questões de Concurso
Comentadas sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 69 questões
Considere abaixo o equilíbrio químico.
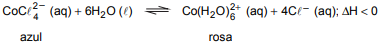
Em uma solução de cor rosa, espera-se observar a cor azul quando:
I. For adicionada solução de ácido clorídrico.
II. O sistema for aquecido.
III. Ao diluir a solução com água.
Está correto o que se afirma APENAS em
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Em meio aquoso, um ácido forte apresenta baixa tendência de transferir um próton a uma molécula de água, ou seja, a água apresenta baixa tendência de receber esse próton.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Pelo princípio de Le Chatelier, uma perturbação em um equilíbrio químico promove um deslocamento no sentido de aumentar a perturbação promovida.
Atente para a seguinte reação reversível em equilíbrio:
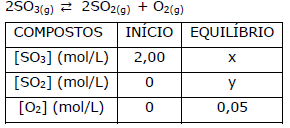
Considerando o quadro acima, é correto afirmar que o
valor de Kc para a reação é
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de
equilíbrio da reação de decomposição do H2O2 é superior ao
verificado em temperaturas mais baixas.
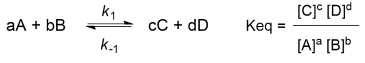
Assumindo que as equações acima são modelos que podem ser aplicados a qualquer reação química, é correto afirmar que, no equilíbrio:
1. as concentrações de A, B, C e D são iguais. 2. as concentrações de A, B, C e D não se alteram com o tempo. 3. a reação para de acontecer, logo, a formação de produtos é interrompida. 4. a constante de velocidade da reação direta (k1) é igual à da reação inversa (k-1).
Assinale a alternativa correta.
2SO3(g)
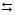 2SO2(g) + O2(g).
2SO2(g) + O2(g).
Inicialmente a pressão parcial do trióxido de enxofre era de 1,6 bar. Ao atingir o equilíbrio foi constatada uma porcentagem de decomposição de 60%.
Se a esse sistema em equilíbrio for adicionado 1 mmol de dióxido de enxofre, mantendo-se constante as condições anteriores, quando o novo equilíbrio for atingido,
Considere um tubo selado contendo inicialmente N2O4 com pressão parcial de 0,45 atm. e temperatura constante. Após o equilíbrio ser atingido, a pressão parcial determinada para o N2O4 foi de 0,08 atm.
Com base nesses dados experimentais, o valor aproximado da constante de equilíbrio em função das pressões parciais dos gases envolvidos, é de
Uma mistura gasosa de 10 mmol de CO e 10 mmol de H2O é colocada em um reator de 500 mL e aquecida até 500 °C, atingindo o equilíbrio:
CO(g) + H2O(g) ⇄ CO2(g) + H2(g) com Kc = 4,00
A concentração, em mol.L–1 de dióxido de carbono nesse
equilíbrio é de
O metanol é preparado industrialmente a partir do gás de síntese (CO e H2), de acordo com a seguinte equação:
CO(g) + 2H2(g) ⇋ CH3OH(g) ΔHo = −21,7 kcal
Pelo princípio de Le Châtelier
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
A adição do catalisador ácido faz que o equilíbrio da reação
seja alcançado mais rapidamente; quando alcançado, o
equilíbrio estará mais deslocado para o sentido dos produtos.
Devido à grande emissão de gases lançados na atmosfera, nas regiões mais populosas é evidente a ocorrência da chuva ácida. Na sua precipitação, um dos ácidos responsáveis pela acidez é o sulfúrico. Um equilíbrio envolvido na formação desse ácido na água da chuva está representado pela equação:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Considere que são colocados 6 mol de SO2, 5 mol de O2 e 4 mol de SO3 num recipiente fechado de 5,0 L para reagirem até o sistema atingir o equilíbrio a dada temperatura. A variação do número de mol dos gases participantes está registrada no gráfico.
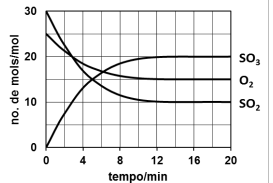
Nestas condições, a constante de equilíbrio, KC, é
igual a:
Sabões são sais de sódio ou potássio de ácidos graxos, obtidos pela reação de gorduras e óleos (triglicerídeos) com NaOH, KOH ou Na2CO3. A reação de saponificação é representada a seguir:
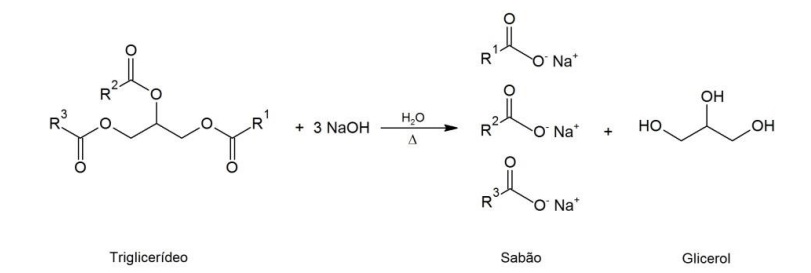
em que R1 , R2 e R3 são cadeias lineares saturadas ou insaturadas, geralmente com doze ou mais átomos de carbono.
Com base nessas informações, considere as seguintes afirmativas:
1. Uma solução aquosa de sabão puro apresenta pH < 7.
2. Adição de ácido forte a uma solução de sabão acarreta precipitação de ácidos graxos.
3. Ca(OH)2 não pode ser usado na obtenção de sabão, pois sais de cálcio de ácidos graxos são insolúveis em água.
4. A obtenção de sabão com Na2CO3 segue a mesma estequiometria que no uso do NaOH.
Assinale a alternativa correta.
Em um recipiente, à temperatura constante, ocorre o seguinte equilíbrio, cuja reação não se encontra balanceada:

Irá provocar deslocamento do equilíbrio, no sentido da
formação de produtos, a:
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
Pelo princípio de Le Chatelier, quando uma força é
aplicada a um sistema em equilíbrio dinâmico, o
equilíbrio tende a se ajustar para minimizar o efeito da
força. Um exemplo disso seria o fato de que uma reação
no equilíbrio tende a seguir em uma reação endotérmica
quando se aumenta a temperatura.
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
O equilíbrio químico ocorre quando há um equilíbrio
dinâmico entre reagentes e produtos em uma reação
química, ou seja, a condição na qual os processos direto
e inverso ocorrem simultaneamente em velocidades
iguais.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
A radioatividade é um fenômeno artificial inventado pelos
cientistas.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
A relação entre as concentrações das espécies participantes de
um equilíbrio químico pode ser expressa matematicamente por
meio de uma equação que considera a concentração de cada
espécie, independentemente de seu estado físico.