Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 501 questões
Em uma aula experimental de química, três soluções foram submetidas à destilação. O gráfico a seguir representa o comportamento dessas soluções.
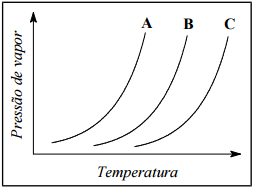
Este gráfico evidencia o ponto de ebulição
A química ambiental trata das reações, dos destinos, dos movimentos e das fontes das substâncias no ar, na água e no solo. Na ausência do ser humano, a discussão seria limitada às substâncias de ocorrência natural. Hoje, com o borbulhar da população na Terra, junto com o contínuo avanço da tecnologia, as atividades humanas têm uma influência sempre crescente na química do meio ambiente.
C. Baird e M. Cann. Química ambiental. 4.ª ed. Porto Alegre: Bookman, 2011.
Julgue o item subsecutivo com relação à química e ao meio ambiente.
A chuva ácida abrange uma variedade de fenômenos
correspondentes à precipitação atmosférica de
quantidades substanciais de ácidos. Os dois ácidos
predominantes na chuva ácida são o ácido sulfúrico
(H2SO4) e o ácido nítrico (HNO3), ambos ácidos fortes.
Em relação às propriedades gerais dos sólidos no estudo de soluções, julgue o item subsequente.
Quando 22,20 g de cloreto de cálcio (de fórmula CaCℓ2 e
massa molar igual a 111 g mol−1) são solubilizados em
água até formar uma solução de volume igual a 1.000 mL,
a concentração de íons cloreto na solução é
igual a 0,4 mol L−1
.
Em relação às propriedades gerais dos sólidos no estudo de soluções, julgue o item subsequente.
Em uma titulação ácido-base, um ácido é titulado com
outro ácido com o objetivo de determinar a sua
concentração. Nesse caso, o titulante é uma solução de
concentração conhecida adicionada por meio de uma
bureta.
Em relação às propriedades gerais dos sólidos no estudo de soluções, julgue o item subsequente.
Titulação é a análise da composição por meio da medida
da massa de um reagente necessária para reagir
completamente com uma dada amostra desconhecida
em solução.
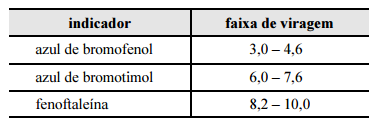
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Das informações da tabela infere-se que a fenoftaleína é o indicador que ocasiona o menor erro de titulação na titulação entre as soluções de NaOH e HCl.
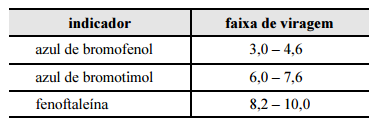
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente.
Para preparar 500 mL de uma solução de HCl com concentração 0,100 mol/L, o volume V de solução estoque necessário, em mL, pode ser calculado por meio da equação a seguir, em que MHCl , C% e d representam, respectivamente, a massa molar do HCl (em g/mol), a concentração (em porcentagem massa/massa) e a densidade (em g/mL) da solução estoque.
V= [5 . MHCl / (C% . d)] . mol . %
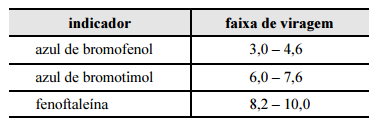
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Em unidades de massa por volume, a concentração da solução de HCl 0,100 mol/L é superior à da solução padrão de NaOH 0,100 mol/L.
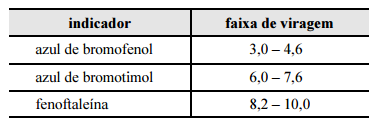
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente. Se o volume gasto da solução padrão de NaOH tiver sido igual a 9,0 mL, então o teor de grupos funcionais básicos presentes na amostra é superior a 0,60 mmol/g.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
Entre os elementos metálicos citados (estrôncio, magnésio
e cobre), o magnésio é o que apresenta menor energia
de ionização.
A seguir, estão listados quatro métodos empregados para a separação de misturas de CH4 e CO2.
I Absorção por água pressurizada: baseia-se na maior solubilidade em água do CO2.
II Criogenia: o resfriamento gradual da mistura faz que o componente com maior ponto de ebulição se liquefaça primeiro.
III Separação por membranas: o componente com menor diâmetro crítico apresenta maior capacidade de permeação.
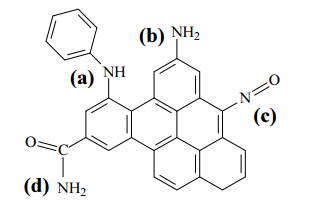
IV Adsorção física seletiva do CO2 por sólidos porosos, como os carbonos ativados: a presença de grupos funcionais básicos na superfície do adsorvente (como, por exemplo, os ilustrados na estrutura abaixo) favorece o processo.
Considerando os métodos apresentados, julgue o item subsequente.
O CO2 é um óxido ácido que, ao se dissolver em água, pode com ela reagir para formar ácido carbônico, de acordo com a equação a seguir.
CO2 + H2O → H2CO3
Considere que uma amostra de biometano seja constituída exclusivamente por CH4 e CO2, com concentração de CO2 igual a 1,0% em quantidade de matéria. Nessa amostra, a concentração de CO2, em porcentagem de massa, é superior a 2,0%.
Com relação aos conhecimentos de química inorgânica e suas aplicações, julgue o próximo item.
Pode-se definir um composto de coordenação como um
composto formado entre um ácido e uma base de Lewis,
sendo o ácido de Lewis um receptor de pares eletrônicos
e a base de Lewis um doador de pares eletrônicos.
Julgue o item subsequente, relativo a soluções.
Considere que a solubilidade do sal de cozinha (NaCl) em
água, a temperatura ambiente (de 20 ºC) e pressão atmosférica
normal (de 1 atm ao nível do mar) seja igual a 0,36. Nesse
caso, é impossível dissolver 500 g de sal em 1 L de água,
mesmo que se aqueça a solução.
A iodometria é um método analítico indireto de titulação de iodo. Dentre os reagentes envolvidos, temos o triiodeto, que se forma segundo a reação em equilíbrio representada a seguir:
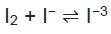
Ao analisar a equação dada e as propriedades químicas das espécies participantes, é correto afirmar
que
Os óxidos correspondem a uma classe de compostos que podem originar as bases e os ácidos, portanto são classificados de acordo com suas características ácido-base. Dentre os óxidos mais importantes, os NOx aparecem pela sua significância como poluentes atmosféricos. O NO2 e o NO são poluentes primários e o N2O, apesar de não ser um importante poluente da troposfera, acaba por exercer grande influência na estratosfera.
Considerando os óxidos em questão, na ordem apresentada no enunciado, indique a opção que relaciona corretamente a sua nomenclatura de óxido ao seu caráter ácido-base frente à reação com a água.
Uma amostra de 8g de hidróxido de sódio impuro foi dissolvida em água e seu volume levado a 1,0 litro em balão volumétrico. Desta solução, 50 mL foram titulados por 32 mL de HCℓ 0,25 mol/L.
O grau de pureza da amostra era de
Ao término de uma aula experimental, foi gerada uma solução aquosa com concentração de íons OH− igual a 1,0x10−2 mol.L −1. O técnico de laboratório providenciou a neutralização dessa solução e realizou o descarte adequado.
Com base nessa situação hipotética, assinale a alternativa que apresenta o pH dessa solução antes de ocorrer a neutralização.
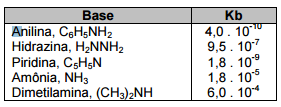
Analisando esses valores, é CORRETO afirmar: