Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Considerando-se a temperatura de 20 ºC, a razão entre a pressão de vapor da acetona pura e a pressão de vapor do removedor de esmalte é, aproximadamente,
Dado Pressão de vapor do acetato de etila: 73 mmHg a 20 ºC Pressão de vapor da acetona: 200 mmHg a 20 ºC M (acetato de etila) = 88,0 g mol-1 M (acetona) = 58,0 g mol-1
Sabendo-se que as condições de reação foram ajustadas para que cada nanopartícula contivesse 250 átomos de prata, a massa de AgNO3 , em miligramas, usada para preparar o sistema aquoso reacional, foi
Dado M (AgNO3 ) = 170 g mol-1
Uma solução salina foi preparada pela dissolução completa de 0,71 g de Na2 SO4 e 1,17 g de NaCℓ, tendo o volume final ajustado, com água destilada, para 250,00 mL num balão volumétrico.
A concentração, em mol L-1 , do íon sódio na solução é
Dado
M (Na2 SO4 ) = 142,0 g mol-1
M (NaCℓ) = 58,5 g mol-1
Uma solução é definida por ser uma mistura homogênea de duas ou mais substâncias.
Nesse sentido, as duas misturas a seguir são consideradas homogêneas:
Alguns ácidos do elemento enxofre são: ácido sulfuroso, ácido tiossulfúrico, ácido sulfídrico e ácido sulfúrico.
As fórmulas químicas desses ácidos estão, respectivamente, apresentadas em:
Leia o texto a seguir e responda à questão.
Uma das etapas do tratamento da água é a fluoretação e, para isto, utiliza-se o ácido fluossilícico (H2SiF6 ), um subproduto da indústria de fertilizantes. É um líquido altamente solúvel e corrosivo, o que dificulta o seu transporte e requer reservatórios apropriados. Os locais para sua armazenagem devem ser frescos e ventilados, em virtude sua natureza tóxica, pois, ao vaporizar-se, decompõe-se em ácido fluorídrico e tetrafluoreto de silício.
Fonte: Manual de Fluoretação da Água para consumo humano. Fundação Nacional de
Saúde (Funasa). Ministério da Saúde. Disponível em:<http://www.funasa.gov.br/site/wpcontent/files_mf/mnl_fluoretacao_2.pdf>
Qual é a quantidade necessária de ácido clorídrico concentrado (37%) para preparar 200 mL de uma solução de ácido clorídrico a 0,4 M?
Dados: (massa específica HCl = 1,19g/mL; massa molecular em gramas 36,5 g/mol)
Pode-se fazer passar um feixe de luz por dois recipientes A e B, um deles contendo uma solução atômica (SA), e o outro contendo uma mistura coloidal (MC), como ilustrado na Figura abaixo.
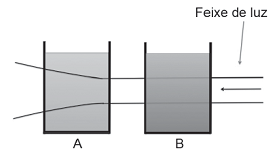
Observe as afirmações a seguir.
I – O recipiente A contém um MC, pois os coloides são suficientemente grandes para espalhar a luz.
II – O recipiente A contém uma SA, pois as moléculas são suficientemente grandes para espalhar a luz.
III – O recipiente B contém uma MC, pois os coloides não são suficientemente grandes para espalhar a luz.
Está correto o que se afirma em:
Uma solução foi preparada com a mistura de 360 g de água pura com 160 g de um solvente orgânico. Em uma certa temperatura, a pressão de vapor da mistura foi 4,3 kPa. Com base no valor da pressão de vapor da mistura, e nas opções abaixo, pode-se concluir que o solvente orgânico usado foi
Dados:
• Pressão de vapor da água pura: 2,0 kPa
• Pressão de vapor do solvente orgânico: 13,5 kPa
• M (água) = 18,00 g mol-1
A concentração de vitamina C (C6 H8 O6 ) foi determinada por coulometria usando eletrodo de platina. No processo, aplicou-se uma diferença de potencial para formar I- , a partir de um excesso de I2 presente na solução onde a amostra foi adicionada. A espécie I3- (formada a partir de I- e I2 ) reagiu com a vitamina C, oxidando-a (ver equações a seguir).
C6 H8 O6 + I3 - → C6 H6 O6 + 3I- + 2 H+
Em que I3 - + 2e → 3I-
Sabe-se que 25,00 mL de solução de amostra foram adicionadas à célula coulométrica, e que foram requeridos 12 min e
52 s da aplicação de 25 mA de corrente para oxidar quantitativamente a vitamina C.
Com base nessa informação, a concentração de vitamina C (em mol L-1 ) na solução de amostra é de
Dado
Carga de 1 mol de elétrons = 96500 C
C = A s
Uma solução aquosa foi preparada pela dissolução de 0,020 mol de hidroxilamina (HO-NH2 ) em 250,00 mL de água pura. A equação do equilíbrio de ionização do HO-NH2 em água e sua constante, a 25°C, estão apresentadas abaixo.
HO-NH2 (aq) + H2O(ℓ) = HO-NH3 + (aq) + OH- (aq) Kb = 5 x 10-9
A concentração, em mol L-1 , de OH- na solução é
Um volume de 500 mL de uma solução aquosa, contendo 0,0040 mol L-1 de Ba2+ foi misturada com 500 mL de uma solução 0,0060 mol L-1 de ácido sulfúrico, promovendo a reação conforme ilustrado na Equação I a seguir:
Ba2+ (aq) + H2SO4 (aq) → BaSO4 (s) + 2 H+ (aq) (Equação I)
O BaSO4 produzido se dissocia, estabelecendo um equilíbrio de solubilidade como indicado na Equação II a seguir:
BaSO4(aq) ⇋ Ba2+ (aq) + SO42- (aq) ; Kps = 1 x 10-9 (Equação II)
A solução resultante (de volume igual a 1000 mL) se encontra a 25°C. Conforme as condições indicadas, e ignorando a
influência da força iônica no equilíbrio de solubilidade, mas considerando o excesso de SO42- em solução, a concentração
aproximada de Ba2+ residual na solução, em mol L-1
, é
É muito comum encontrar as substâncias KNO3 , NaOH, e HCℓ em produtos comercializados e de uso cotidiano.
Observe as afirmações a seguir concernentes a propriedades dessas substâncias
I - NaNO3 , ao ser dissolvido em água, altera significantemente o pH.
II - NaOH se dissocia parcialmente quando dissolvido em água, sendo, por isso, uma base fraca.
III - HCℓ é um gás muito solúvel em água, onde se dissocia diminuindo o pH.
Está correto APENAS o que se afirma em
Deseja-se preparar um litro de solução de ácido sulfúrico 0,1 mol/L a partir de uma amostra de ácido sulfúrico concentrado. Acerca do tema, Informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir e assinale a alternativa com a sequência correta.
( ) No preparo de uma solução H2SO4 a partir do ácido concentrado, deve-se, primeiramente, colocara água destilada no balão volumétrico e, logo após, adicionar o ácido concentrado.
( ) Caso o frasco da solução contendo ácido sulfúrico 0,1 mol/L caia sobre a bancada do laboratório, pode-se fazer uso do bicarbonato de sódio para neutralização da solução derramada.
( ) O frasco de ácido sulfúrico concentrado pode ser armazenado, sem riscos, nos mesmos locais onde se encontram frascos de ácido acético.
Por que cortar cebola nos faz chorar? No momento em que cortamos esse vegetal, as células deste são quebradas e liberam enzimas denominadas alinases e, também, um grupo de compostos denominados suIfóxidos-S-alquenil cisteína. Esses compostos entram em contato com as alinases e, por meio de reações complexas, produzem o sulfóxido de tiopropanal, que é o gás causador das lágrimas.
WOLKE, R.L; O que Einstein disse ao seu cozinheiro - Mais ciência na cozinha, vol. 2, Zahar 2005. (com adaptações)
Uma das recomendações para se evitar
o sulfóxido de tiopropanal, no momento
em que se corta a cebola, é deixá-las, por
pelo menos duas horas, na geladeira,
antes de cortá-las. Isso porque, esse
procedimento acarretará
Uma solução de NaCℓ foi feita dissolvendo, totalmente, 0,100 g do sal em água antes de transferir essa mistura para um balão volumétrico de 100,00 mL onde a solução teve seu volume ajustado. A incerteza da massa de NaCℓ é 0,001 g (calculada considerando duas etapas: a tara e a pesagem propriamente dita do sal), e a incerteza do balão é 0,10 mL.
Assim, essa solução teria uma incerteza de concentração, em gL-1 , de
Uma solução de álcool desinfetante foi preparada, a 20°C, com água e etanol, sendo que a quantidade desse último na mistura foi de 71,2% massa/massa. O valor aproximado da pressão de vapor da mistura, em mmHg, é
Dados
Pressão de vapor do etanol puro: 44 mmHg a 20°C
Pressão de vapor da água pura: 18 mmHg a 20°C
M (água) = 18,00 g mol-1
M (etanol) = 46 g mol-1
Uma solução ideal foi feita misturando 360,00 mL de água e 1 mol de um soluto não volátil, armazenando a mesma a 20°C.
O valor aproximado da pressão de vapor, em mmHg, da mistura é
Dados
Pressão de vapor da água pura: 18 mmHg a 20°C
Massa específica da água pura: 1,00 g mL-1
M (H2O) = 18,00 g mol-1