Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.136 questões
Em um laboratório, preparou-se uma solução básica de NaOH, pesando-se uma determinada massa do reagente. Visto que o NaOH tem propriedade higroscópica, esta solução foi padronizada com um padrão primário, biftalato ácido de potássio. Para este procedimento, utilizou-se 25mL da solução de NaOH preparada e titulou-se com biftalato ácido de potássio. A massa de biftalato de potássio utilizada para padronização foi de 0,4000g. A reação entre titulante e titulado, pode ser representada pela equação:
KHC8H4O4(s) + NaOH(aq) → KNaC8H4O4(aq) + H2O(l)
No laboratório de biologia, dentre os fixadores mais utilizados na preservação de animais para uso didático, encontram-se o formol e o etanol nas respectivas concentrações: 10% e 70%. Um professor solicitou ao técnico de laboratório que preparasse meio litro de formol a 10% e um litro de álcool a 70%.
Os reagentes disponíveis para o preparo dessas soluções eram: um litro de formol a 37% e um litro de etanol a 98%. Quais foram as quantidades utilizadas pelo técnico para preparar as soluções de formol e álcool, respectivamente?
Uma massa de 0,10 g de ácido benzoico (112 g mol-1) foi dissolvida em solvente apropriado e transferida quantitativamente para um erlenmeyer e adicionaram-se gotas de fenolftaleína. Posteriormente, adicionou-se uma solução de NaOH (40 g mol-1) de concentração desconhecida que consumiu um volume de 8,0 mL. A reação química que ocorre entre o ácido e a base está apresentada na figura que segue.
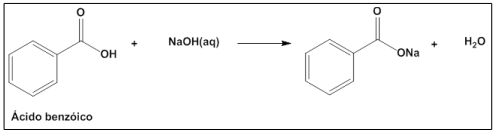
A concentração, em mol L-1, da solução de hidróxido de sódio é, aproximadamente:

Acerca dos resultados observados após a realização das misturas indicadas no quadro, julgue o seguinte item.

Acerca dos resultados observados após a realização das misturas indicadas no quadro, julgue o seguinte item.

Acerca dos resultados observados após a realização das misturas indicadas no quadro, julgue o seguinte item.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Pela definição de Brønsted‐Lowry, um ácido é uma
espécie que tem a tendência de perder ou doar um
próton e uma base é uma espécie que apresenta a
tendência de receber ou adicionar um próton.
Julgue o item seguinte, relativo a grandeza, unidade de medida e soluções.
Considere‐se que uma alíquota de 5 mL de uma solução aquosa de cloreto de potássio com concentração igual a 1 mol L−1 seja transportada para um balão volumétrico de 1.000 mL. Nesse caso, após ser realizada a diluição dessa alíquota até o preenchimento do balão volumétrico, a nova concentração dessa solução será igual a 0,02 mol L−1.
Julgue o item seguinte, relativo a grandeza, unidade de medida e soluções.
Titulação é a análise da composição pela medida do volume de uma solução (titulante) necessário para reagir com um determinado volume de outra solução. Em uma titulação ácido‐base, um ácido é titulado com uma base.
A titulação é realizada com a adição gradativa de uma
solução de um reagente à solução de outro, até que o ponto de equivalência seja assinalado por uma mudança de cor ou outra indicação.
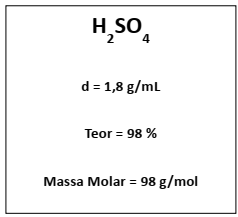
Deseja-se preparar 1 L de solução do ácido a 1 mol/L, partindo do reagente concentrado. Podemos informar que o volume do ácido concentrado a ser usado na preparação vale, aproximadamente:
A massa de hidróxido de sódio necessária à preparação de 500 mL de uma solução 0,2 mol/L, é:
Adotar nessa questão, massas atômicas: H = 1, O = 16, Na = 23.
Email institucional
Para: laborató[email protected]
Prezado técnico de laboratório
Solicito 100 mL de solução de ácido clorídrico de concentração 0,5 mol/L para realização de aula experimental, às 14 (catorze) horas do dia 23/04/2018.
Cordialmente,
Dr. Ernesto Rutherford
O técnico de laboratório precisará preparar a solução solicitada a partir do reagente ácido clorídrico PA 37% (massa/massa). Quanto de reagente, em mililitros, será necessário para o preparo da solução?
Dados: densidade ácido clorídrico= 1,20 g/mL;
Massas molares (g/mol): H= 1; Cl= 35,5
Considerando-se que as massas molares em g.mol-1 são S=32, H= 1 e O= 16, a massa de H2SO4 presente em 500 mL de solução é de, aproximadamente,