Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Assinale a alternativa que completa corretamente a lacuna.
“Para o preparo de 1L (litro) de solução de Hidróxido de Sódio (NaOH) 10M (molar), é necessário adicionar __________ de hidróxido de sódio (NaOH) em 500mL (mililitros) de água destilada e após, completar o volume para 1L (litro) com água destilada.”
Em uma ação policial para combate ao tráfico de substâncias psicoativas (“drogas de abuso”), foram apreendidos 10.000 (dez mil) tubos plásticos, de formato cônico, do tipo eppendorf, com volume de 1,5 mL, cujo interior apresentava sólido pulverizado de coloração bege, que preenchia um volume de 1,0 mL de cada um dos tubos. Durante o exame preliminar do material, foram feitas as seguintes observações:
• Todos os tubos apresentavam as mesmas dimensões e foram preenchidos com o mesmo volume, massa e tipo de pó.
• A massa do material apreendido (correspondente à soma da massa dos tubos e do pó contido em todos os tubos) era de 15.000g (quinze mil gramas).
• A massa de 10 tubos, obtida após a remoção completa do pó de cada um deles, era de 10,0g.
Além disso, por meio de técnicas de amostragem e analíticas, determinou-se que o pó, em todos os tubos, apresentava um teor de cocaína de 5,0%.
Em uma ação policial para combate ao tráfico de substâncias psicoativas (“drogas de abuso”), foram apreendidos 10.000 (dez mil) tubos plásticos, de formato cônico, do tipo eppendorf, com volume de 1,5 mL, cujo interior apresentava sólido pulverizado de coloração bege, que preenchia um volume de 1,0 mL de cada um dos tubos. Durante o exame preliminar do material, foram feitas as seguintes observações:
• Todos os tubos apresentavam as mesmas dimensões e foram preenchidos com o mesmo volume, massa e tipo de pó.
• A massa do material apreendido (correspondente à soma da massa dos tubos e do pó contido em todos os tubos) era de 15.000g (quinze mil gramas).
• A massa de 10 tubos, obtida após a remoção completa do pó de cada um deles, era de 10,0g.
Além disso, por meio de técnicas de amostragem e analíticas, determinou-se que o pó, em todos os tubos, apresentava um teor de cocaína de 5,0%.
Em um laboratório de análise química, há três tambores plásticos (X, Y e Z) destinados ao descarte de soluções e nos seus rótulos se lê os seguintes dizeres:
• Tambor X: descarte de soluções ácidas.
• Tambor Y: descarte de soluções básicas.
• Tambor Z: descarte de soluções neutras.
Ao perito desse laboratório, foi solicitado que fizesse o descarte de 3 soluções aquosas (1, 2 e 3), cujas características são descritas a seguir:
• Solução 1: cloreto de sódio 0,1 mol/L.
• Solução 2: mistura de 50 mL de ácido clorídrico 0,2 mol/L, com 20 mL de hidróxido de sódio 0,5 mol/L.
• Solução 3: glicose 0,1 mol/L (lembrando que a glicose é poliálcool que apresenta ainda um grupo aldeído (C6H12O6(aq))).
Considerando que o correto descarte tenha sido feito pelo perito, assinale a alternativa correta.
Uma análise iodométrica por titulação indireta foi utilizada para se determinar o teor de NaOCl de um desinfectante adquirido por uma estação de tratamento de água. Para isso, 25,0 mL do desinfectante foram diluídos a 1000 mL em um balão volumétrico. Um volume de 25,0 mL dessa solução diluída foi transferida para um erlenmeyer e tratada com excesso de KI, reduzindo OCl- a Cl- e produzindo I3- . A redução de I3- a I- foi executada via titulação com uma solução 0,10 mol L-1 de Na2S2O3, (que foi oxidado a Na2S4O6). Foram necessários 9,00 mL para se atingir o ponto de viragem do indicador utilizado. Assim, o percentual em %m/v, de NaOCl no desinfectante adquirido é de aproximadamente
Dados massas molares (g mol-1): O = 16; Na = 23; S = 32; Cl = 35,5; I = 127.Dados massas molares (g mol-1): NaOH = 40,0; KHP = 204,22.
Dados: massa molar CaCO3 = 100,0 g mol-1 .
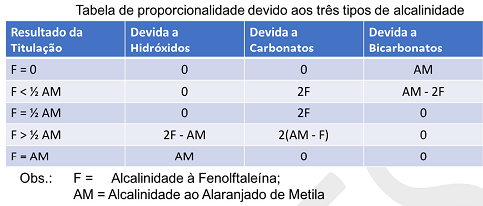
A dureza total de uma amostra de 50,0 mL de água foi determinada por titulação com EDTA de concentração 0,010 mol L-1. O volume de EDTA gasto foi de 8,00 mL. A dureza total dessa amostra de água, expressa em mg CaCO3 por litro (mg L-1 CaCO3), é de
Dado: massa molar CaCO3 = 100 g mol-1
.
Em pequenas estações de tratamento de água, dióxido de cloro, um forte agente oxidante, costuma ser preparado in situ de forma a atingir uma concentração de dióxido de cloro de 15 g L-1, conforme equação química dada abaixo:
HCl + NaClO2 → ClO2 + NaCl + H2O
Considerando-se uma estação de tratamento de 10.000 litros, o volume, em litros, de ácido clorídrico necessário para atingir a concentração de dióxido de cloro necessária é de aproximadamenteObs.: Considere que a reação ocorre estequiometricamente com rendimento de 100%. Dados: Massas molares, g mol-1: H = 1; Cl = 35,5; Na = 23; O = 16. Ácido Clorídrico: densidade = 1,2 g mL-1; Título (em massa): 37%.
A respeito da classificação da matéria, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O ar atmosférico (não poluído em um dia ensolarado e sem nuvens) é uma mistura heterogênea de gases atmosféricos, tais como O2, N2, CO2, alguns gases nobres, O3, entre outros.
( ) A água do mar (sem areia) é uma mistura homogênea de água e sais, como NaCl, MgCl2, entre outros sais.
( ) O açúcar de mesa é formado pela substância pura sacarose obtida da cana-de-açúcar.
( ) A pólvora, uma mistura homogênea, pode ser obtida a partir de KNO3, enxofre (S) e carvão (C).
Assinale a sequência correta.
No Brasil, o formol 10% ainda é empregado como principal solução para a fixação de cadáveres bem como meio de armazenamento de peças anatômicas.
Assinale a alternativa que apresenta a diluição correta para se obter a solução de formol a 10%