Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.136 questões
Considere as três reações químicas indicadas que envolvem ácido sulfúrico e assinale a alternativa incorreta.
I. H2SO4 + CaCO3 → CaSO4 + H2O+ CO2
II. H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
III. H2SO4 + Mg(OH)2 → MgSO4 + 2 H2O
O modelo mais tradicional considera como ácido uma substância que libera o íon H+ e como base uma substância que libere o íon OH-. No entanto, esse modelo não contempla a neutralização de ácidos por moléculas que não contenham o íon OH-, como no caso da reação da amónia com o ácido clorídrico:
HCI(g) + NH3(I) ⇄ NH4+ + Cl-
O modelo de Lowry-Bronsted altera este modelo, de forma a abranger reações como a acima. Assinale a alternativa que corresponde a essa nova definição.
Sobre a bauxita, que é utilizada como principal fonte de extração do alumínio metálico, analise as afirmativas a seguir e assinale a alternativa correta.
I. É uma mistura de óxidos de óxidos de alumínio, principalmente Al2O3, sendo abundante na natureza.
II. A extração do alumínio metálico, a partir desse óxido, envolve um processo de redução eletroquímica.
III. A dificuldade de extração do alumínio desse material fez com que o alumínio metálico, embora seja o metal mais abundante na crosta terrestre, só passasse a ser utilizado amplamente a partir do século XIX.
Estão corretas as afirmativas:
As substâncias inorgânicas possuem diversas aplicações: o Aℓ2(SO4)3 é utilizado em uma das etapas do tratamento de água, o H2SO4 é matéria-prima para produção de fertilizantes, o Aℓ (OH)3 é empregado em medicamentos, e o Aℓ2O3 é utilizado na fabricação de materiais cerâmicos.
A respeito dessas substâncias, verifica-se que o
Uma solução aquosa de bicarbonato de sódio (NaHCO3) foi preparada em um balão volumétrico de 250,00 mL utilizando-se 10,0 g do soluto, com o volume final ajustado pela adição de água pura. Dessa solução foi retirada uma alíquota de 25,00 mL, que foi transferida para um balão de 100,00 mL, no qual o volume final foi ajustado pela adição de água pura.
Os valores mais próximos das concentrações, em quantidade de matéria (mol L-1), da solução inicial e da solução após a diluição são, respectivamente,
Dado
M (NaHCO3) = 84,0 g mol-1
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

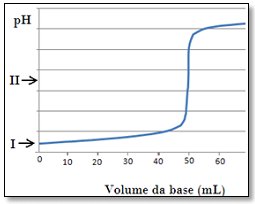
A figura apresentada ao lado representa a titulação para 100 mL de uma solução de HCl com uma solução padrão de NaOH 0,2 mol L-1 .
Os valores de pH indicados pelas setas no gráfico são, respectivamente:
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

As afirmativas a seguir referem-se a reações de neutralização.
I. Sais derivados de ácidos fortes com bases fortes se dissolvem na água para produzir íons H3O+ ou íons OH- .
II. A reação estequiométrica entre um ácido forte e uma base fraca produz uma solução ácida.
III. A reação estequiométrica entre um ácido fraco e uma base forte produz uma solução ácida.
IV. Sais derivados de ácidos ou bases fracas se dissolvem na água para produzir íons H3O+ ou íons OH- .
Dentre as afirmativas, estão corretas apenas
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

A análise volumétrica de uma determinada amostra de um ácido diprótico, com NaOH 0,100 mol L-1 , foi realizada usando-se o seguinte procedimento: inicialmente, coletou-se uma alíquota da amostra com o instrumento (1) indicado na figura ao lado; após a devida aferição de volume, a alíquota foi transferida para o instrumento (2); em seguida, o volume do instrumento (2) foi aferido com água destilada; posteriormente, uma alíquota da solução obtida foi coletada com o instrumento (3), devidamente aferido, e transferida para o instrumento (4), onde adicionou-se um indicador apropriado; ao acionar o instrumento (5), observou-se a mudança da cor da solução titulada após a adição do volume indicado pela seta.
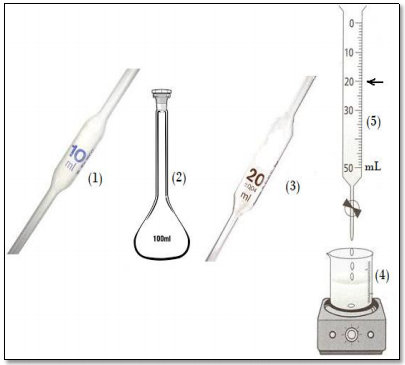
Para a reação envolvida na titulação, devidamente balanceada, o resultado da soma dos coeficientes estequiométricos é
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5


Baseando-se nessa descrição, é correto afirmar que a concentração do ácido na amostra, em mol L-1 , é
O laboratório que está sujeito à norma na questão anterior é um gerador contínuo de resíduos de mercúrio. O tratamento adequado desses resíduos consiste na sua acidificação com ácido nítrico seguido da adição de tioacetamida (CH3SNH2). Esse último sofre decomposição, gerando íons sulfeto em meio ácido.
Dados: M (g.mol-1 ): Hg = 200; S = 32; N = 14; H = 1; KPS: HgS = 2 x 10-53 .
Uma bombona de 20L contém um resíduo de mercúrio em concentração de 0,1 mol.L-1 . Qual é a massa (em gramas) mínima necessária de tioacetamida para tratar esse resíduo?
A titulação redox se baseia numa reação de oxirredução entre analito e titulante. A titulação utilizando permanganato de potássio facilita a visualização, porque a solução do íon permanganato possui cor violeta intensa, enquanto que a solução de Mn2+ é quase que incolor. A solução de permanganato pode ser utilizada para titular solução de íons Fe2+ .
Ao se titular uma alíquota de 10 mL de uma solução 1,1 mol.L-1 de Fe2+, o volume esperado de permanganato 0,100 mol.L-1 a ser consumido é de: