Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Resíduo é tudo aquilo que não foi aproveitado e precisa ser descartado. Ele pode ser classificado como perigoso; não inerente, ou seja, apesar de o resíduo não ser perigoso ele pode conter solubilidade em água (capacidade de determinada substância em se dissolver na água); e inerente, em que a água continuará potável mesmo após ter entrado em contato com o resíduo líquido. Caso o descarte desses resíduos líquidos não seja realizado corretamente, pode acarretar danos para o meio ambiente e para a saúde.
Sobre o descarte dos resíduos líquidos, podemos afirmar que:
Assinale a alternativa CORRETA:
I. Decantação/Flotação é um processo de separação de misturas heterogêneas usado para sedimentar os flocos formados no tratamento físico-químico.
II. Coagulação e Floculação química, técnica empregada para desestabilizar partículas coloides (misturas em que as partículas dispersas têm diâmetro compreendido entre 1 nanômetro e 1 micrometro) do efluente com o auxílio de sais de ferro ou alumínio polieletrólitos ou orgânicos, formando partículas maiores (flocos ou flóculos).
III. Filtração é a remoção de partículas ao filtrar a água com qualquer material poroso, como a areia.
IV. Ultrafiltração é um sistema de separação por membranas usado para reter partículas de 1 a 100 nm, remover coloides, moléculas, cistos minerais e micro-organismo presentes no resíduo líquido.
V. Esterilização da água por raios ultravioleta é uma técnica que visa impedir a proliferação de bactérias e vírus, evitando a contaminação por cólera, disenteria e febre tifoide.
Estão CORRETAS:
Os hidretos são compostos inorgânicos binários (possuem dois elementos químicos) que apresentam na sua constituição o elemento hidrogênio acompanhado de outro elemento químico qualquer.
De acordo com as características dos hidretos, assinale (V) para alternativa verdadeira e (F) para falsa:
( ) Hidreto iônico apresenta um elemento metálico acompanhando o hidrogênio. Os elementos metálicos mais comuns são os metais alcalinos,alcalinoterrosos (com exceção do berílio e do magnésio), Gálio, Índio, Tálio e os lantanídeos.
( ) Os hidretos iônicos não são reativos com água.
( ) Hidreto molecular (ou covalente) são hidretos formados pela combinação do hidrogênio com elementos dos grupos 13 a 17 (famílias: do boro, do nitrogênio, calcogênios e halogênios).
( ) Hidreto metálico ou intersticial possuem um metal de transição (elemento que apresenta o subnível d como mais energético/ famílias B) acompanhando o hidrogênio.
A sequência CORRETA é:
Os óxidos possuem diferentes tipos de reação com a água.
Se um óxido ácido reagir com a água,teremos a formação de um ácido, representado através da seguinte fórmula:
Assinale a alternativa CORRETA:
Reações químicas com óxidos são processos químicos que ocorrem quando substâncias desse grupo de substâncias inorgânicas reagem com água (H2O), base ligada a um metal ou amônio e ácido ligado a um ânion qualquer.Os óxidos são substâncias bastante reativas, o que faz deles formadores de diversas outras substâncias.De acordo com os diferentes tipos, os óxidos podem ser:
I. Óxidos ácidos.
II. Óxidos básicos.
III. Óxidos neutros.
IV. Óxidos anfóteros.
V. Óxidos duplos, mistos ou salinos.
Estão CORRETAS:
Muitos íons metálicos formam complexos estáveis, solúveis em água, com muitas aminas terciárias. A formação desses complexos serve como base nas titulações complexométricas de íons metálicos.
Sobre as titulações complexométricas, assinale a alternativa INCORRETA.
A curva para a titulação de um ácido fraco por uma base forte é muito similar no formato àquela para a titulação de um ácido forte por uma base forte. Quando ácidos fracos contêm mais de um átomo de hidrogênio ionizável, como no ácido fosfórico (H3PO3 ), a reação com OH- ocorre em uma série de etapas.
Considere o gráfico a seguir, que representa a curva de titulação para a reação de 50 mL de 0,1 mol/L de H3PO3 com 0,1 mol/L de NaOH.
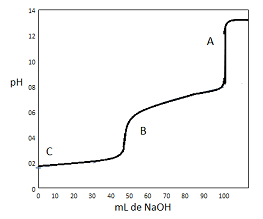
Segundo a curva de titulação, as espécies químicas A, B
e C são, respectivamente:
Considere que no preparo de uma solução de HCl 0,1 mol/L um técnico utiliza 4,5 mL da solução de estoque do reagente concentrado. A solução de estoque tem as seguintes especificações:

Nessas condições, e para garantir uma concentração
mais próxima possível daquela que o técnico pretende,
é correto afirmar que o balão volumétrico utilizado para
o preparo dessa solução é de:
A lei de absorção, também conhecida como lei de Beer-Lambert ou somente lei de Beer, diz quantitativamente como a grandeza da atenuação depende da concentração das moléculas absorventes e da extensão do caminho sobre o qual ocorre a absorção.
Considere, hipoteticamente, que uma solução 0,10 mol/L de permanganato de potássio (KMnO4 ) apresenta uma absorbância igual a 0,340, quando medida em uma célula de 2,0 cm no comprimento de 525 nm.
Nessas condições, é correto afirmar que a absortividade molar do KMnO4 é igual a:
A concentração do hidróxido de sódio (NaOH) pode ser determinada via titulação por uma solução-padrão de ácido clorídrico (HCl). Considere que nesse processo de titulação foram consumidos 25 mL de HCl 0,1 mol/L.
Sabendo que o volume da base é de 50 mL, é correto afirmar que a concentração NaOH em gramas por litro é igual a:
Uma solução aquosa de um soluto desconhecido é testada com papel tornassol azul e apresenta coloração vermelha. A solução é um condutor fraco comparado com uma solução de NaCl da mesma concentração.
A partir dessas informações, é correto afirmar que o soluto dessa solução é o composto:
O preparo de soluções é uma das atividades essenciais na vida profissional do técnico de laboratório em Química. O hidróxido de sódio é a base mais utilizada no preparo de soluções-padrão, embora os hidróxidos de potássio e de bário sejam também empregados.
Considere que um técnico de laboratório em Química, durante o preparo de uma solução-padrão de hidróxido de sódio (NaOH), realizou os seguintes procedimentos:
I. Considerou o grau de pureza da base, no rótulo do reagente, para calcular a massa do NaOH necessária para o preparo da solução.
II. Colocou a quantidade já pesada da base em um béquer e dissolveu em água destilada, usando um bastão de vidro para facilitar a dissolução.
III. Transferiu, quantitativamente, com o auxílio de uma bureta, o volume total de água que interage com o hidróxido de sódio.
Estão corretos os procedimentos:
Considere que, em um experimento de titulação, um estudante obteve o resultado conforme a figura a seguir.
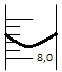
Assinale a alternativa que expressa a leitura correta
feita pelo aluno no volume obtido na bureta em mililitros,
sabendo que sua incerteza é de ±0,01 mL.
Considere que, em um experimento de química, um técnico misturou as soluções de três balões volumétricos em um único recipiente. Os balões tinham as seguintes especificações:
Balão A: 200 mL de NaOH 0,1 mol/L
Balão B: 100 mL de NaOH de concentração desconhecida
Balão C: 200 mL de NaOH 0,05 mol/L
Considerando o volume total da mistura é de 500 mL e que a mistura é totalmente consumida na reação química com 500 mL de ácido clorídrico (HCl) 0,1 mol/L, é correto afirmar que a concentração da solução de NaOH do balão B é igual a:
No laboratório, foram avaliadas algumas propriedades de três substâncias, identificadas como 1, 2 e 3. Os resultados encontram-se dispostos na tabela.
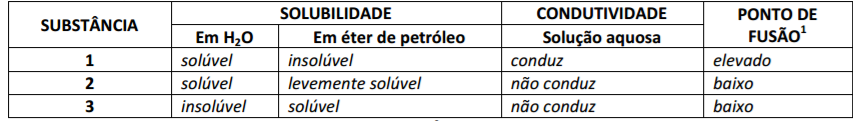
São considerados elevados, pontos de fusão acima de 150 ºC.
Com base nas informações apresentadas na tabela, é correto afirmar-se que
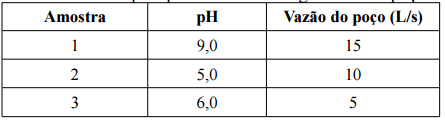
Sendo assim, o pH resultante desta mistura será: