Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.136 questões
Texto para a questão.
Surfactantes ou agentes tensoativos são moléculas que se associam espontaneamente, em solução aquosa, a partir de uma determinada concentração. Apresentam uma região apolar e outra polar, ou iônica, e podem ser divididos em neutros ou iônicos. Os tensoativos iônicos podem ser catiônicos ou aniônicos ou, ainda, anfóteros, quando ambas as cargas estão presentes no surfactante. Em soluções diluídas, as moléculas dos surfactantes apresentam-se dispersas e, em soluções mais concentradas, organizam-se em agregados moleculares, que geralmente contêm de 50 a 100 moléculas, denominadas de micelas.
I. M. Rizzatti, D. R. Zanette e L. C. Mello. Determinação
potenciométrica da concentração micelar crítica de
surfactantes: uma nova aplicação metodológica
no ensino de química. In: Química Nova, v. 32,
n.° 2, 2009, p. 518-521 (com adaptações).
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Deseja-se preparar duas soluções saturadas na temperatura de 20 °C, uma contendo o sal menos solúvel e outra contendo o sal mais solúvel nessa temperatura. Para cada uma das soluções, será empregado o mínimo possível dos sais e será utilizado 1 L de água, mantida a 20 °C durante todo o processo de dissolução. A massa específica da água é igual a 1.000 kg m-3.
Com base nesse caso hipotético e no gráfico, assinale a alternativa que apresenta, correta e respectivamente, as massas aproximadas dos dois sais necessárias para o preparo dessas soluções.
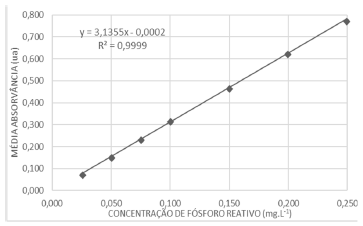
Nas mesmas condições analíticas uma amostra de água doce de um reservatório classe 2 com concentração desconhecida apresentou absorvância média 0,142 ua.
A concentração de fósforo reativo (em mg.L-1) na amostra é, aproximadamente, de
A alcalinidade total da amostra, em mgCaCO3.L-1, corresponde aproximadamente a
Dados: massas molares em g.mol-1: C = 12; O = 16; Ca = 40. Equação para a titulação: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
Se a quantidade de matéria orgânica e de microrganismos aeróbios no esgoto for alta, a diminuição da concentração de oxigênio dissolvido no meio provocará alterações no ambiente aquático.
A quantidade de oxigênio necessária para o consumo da matéria orgânica pode ser avaliada em laboratório, utilizando o excesso do reagente
O volume previsto de titulado que deverá ser gasto nesse processo, considerando nenhum tipo de perda será de
Dados: massas molares (g.mol-1) C= 12; O=16; Na= 23.
Dados: massas molares em g.mol-1 : H = 1; O = 16; Na = 23.
Uma professora propõe uma aula à beira do mar para observar transformações químicas visíveis que a maresia provoca nesse ambiente. Maresia é o nome dado a uma névoa fina, úmida e salgada que às vezes paira sobre as cidades do litoral, flutuando ao longo da costa. Esse spray é formado por bilhões de gotículas de água do mar, que sobem ao ar toda vez que uma onda arrebenta na praia. O fenômeno que essa névoa provoca é retratado pelos estudantes, ao caminhar pela praia, e apresentado abaixo.

O processo químico apresentado nessas imagens pode ser classificado como uma reação de
Ao reagir com água, o óxido nitroso apresenta o comportamento de
Foi realizada uma titulação de 50 mL de uma solução de um diácido fraco de concentração 0,1 mol/L. Como titulante foi utilizada solução de NaOH a 0,1 mol/L. O volume gasto para atingir o ponto de equivalência nessa titulação foi de 50 mL. Escolha, dentre as opções, o indicador (dada a faixa de viragem) menos apropriado para a titulação, considerando um erro de 1%.
(Dados para o diácido: pKa1 = 3 e pKa2 = 8.)
Uma indústria metalúrgica, para analisar o teor de ferro em uma de suas peças, procedeu da seguinte forma: Pesou uma amostra de 0,6 g desta peça, converteu todo o ferro presente em íons Fe2+(aq) e titulou com uma solução de permanganato de potássio de concentração 0,01 mol.L–1, consumindo 22 mL dessa solução.
Equação iônica: MnO4–(aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + Fe3+(aq) + H2O(l)
Qual o teor de ferro, aproximadamente, em % massa, presente na peça analisada?
Calcular a ordem de grandeza da concentração de amônia após misturarem‐se 50 mL de uma solução aquosa de amônia 0,01 mol/L com 50 mL de uma solução aquosa de ácido clorídrico a 0,01 mol/L.
(Dado: A constante de acidez do íon amônio é 5,6 X 10–10.)
Lê-se nas instruções de preparo de um suco concentrado de laranja as seguintes instruções:
Para o preparo de suco:
− dissolva uma parte do suco concentrado para sete partes de água.
Para o preparo de refresco:
− dissolva uma parte de suco concentrado para nove partes de água.
Considerando o preparo de um litro de suco e de um litro de refresco, o suco concentrado foi diluído, em cada situação,
respectivamente, em
Na titulação de dois sucos de laranja com hidróxido de sódio, NaOH, 0,10 mol.L−1 foram obtidos os resultados abaixo.

Considerando apenas o ácido cítrico, um ácido triprótico, conclui-se que a laranja pera é