Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.136 questões
− Hematita: Fe2O3; − Magnetita: FeO.Fe2O3; − Siderita: FeCO3; − Goethita: FeO(OH); e − Pirita: FeS2. É correto afirmar que
Considere o gráfico abaixo sobre a evolução da concentração de gás carbônico no ar.
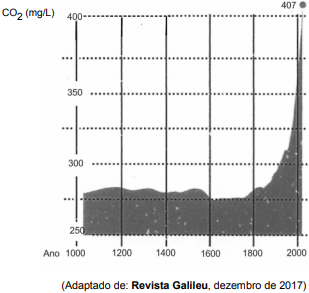
De acordo com o gráfico, do ano de 1600 até o último registro, a concentração de gás carbônico, em mol/L, passou de
Um técnico de laboratório precisava de uma solução 2000 mol/m3 de hidróxido de cálcio, muito usado como agente floculante para tratamento de efluentes. Ele encontrou sobre a bancada do laboratório dois frascos contendo soluções aquosas de hidróxido de cálcio: no primeiro frasco havia 2000 mL de solução 3 mol/L; no segundo frasco havia 1000 mL de solução 111 g/L. Considerando que o técnico utilizou toda a solução menos concentrada, o volume da solução mais concentrada necessário para obter a solução desejada é de:
Dados: H = 1 g/mol; O = 16 g/mol; Ca = 40 g/mol

A concentração da solução de NaOH que o aluno encontrou foi:

Um técnico responsável pelo laboratório de química, precisa preparar uma solução aquosa 0,0100M de KMnO4 para uma aula de química. Portanto, seguiu as seguintes recomendações:
O rompimento da barragem do Fundão, localizada no município de Mariana (MG), aconteceu por volta das 15 horas no dia 05 de novembro de 2015 e causou uma enxurrada de lama no distrito de Bento Rodrigues, em Mariana, na região Central de Minas Gerais. A lama de rejeitos de minério que vazou da barragem da Samarco - cujos donos são a Vale a anglo-australiana BHP Billiton - em Mariana (MG) já chegou ao mar, domingo, dia 22 de novembro de 2015, após passar pelo trecho do Rio Doce no distrito de Regência, em Linhares, no Norte do Espírito Santo, segundo o Serviço Geológico do Brasil.

A água com tonalidade turva, que começou a desaguar na praia de Regência no fim da tarde do
sábado, 21 de novembro, pode ser classificada como:
A padronização do permanganato de potássio foi realizada utilizando-se o padrão primário oxalato de sódio e a titulação espectrofotométrica conforme a seguinte reação:
2KMnO4(aq) + 8H2SO4(aq) + 5Na2C2O4(aq) → 5Na2SO4(aq) + K2SO4(aq) + 2MnSO4(aq) + 10CO2(g) + 8 H2O(l)
Pesou-se 0,1985g de oxalato de sódio diluindo-o em 50 mL de solução de ácido sulfúrico pH 2,5. Em seguida, monitorou-se a absorbância em λ = 545 nm registrando-se os seus valores em função do volume de KMnO4 adicionado.
Sabendo-se que a única espécie que absorve a luz, nesse comprimento de onda, é o
permanganato de potássio, o perfil característico dessa titulação está em
O técnico recebeu a tarefa de determinar o teor de vitamina C (C6H8O6 – MM=176,12 g mol-1 ) em amostra de comprimidos. Após pulverização e homogeneização pesou uma amostra de 0,1852 g do pó, transferiu para erlenmeyer e dissolveu com cerca de 20,0 mL de águ a destilada. Completada a dissolução adicionou 2,0 g de iodeto de potássio (KI) e 5 mL de ácido sulfúrico (H2SO4) 0,5 mol L-1 . Titulou com solução padrão de iodato de potássio (KIO3) 0,0250 mol L-1 , utilizando como indicador solução de amido a 1%, o volume da solução de iodato de potássio gasto foi de 13,2 mL. Considere a sequência de reações abaixo.
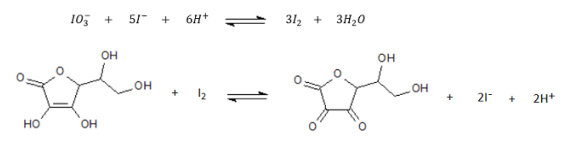
Com base nessas informações conclui-se que o teor de vitamina C no comprimido é de
aproximadamente:
Um dado importante para avaliar a qualidade da água é a determinação do índice de dureza da água, que corresponde à presença dos íons Ca2+ e Mg2+. As equações envolvidas para essa avaliação são as seguintes:
Ca2+ + H2Y2- ⇋ CaY2- + 2H+
Ca2+ + MgY2- ⇋ CaY2- + Mg2+
Mg2+ + HIn2- ⇋ MgIn- + H+
MgIn- + H2Y2- ⇋ MgY2- + HIn2- + H+
O técnico do laboratório recebeu e protocolou uma amostra de água para análise de dureza. O volume da amostra utilizado na titulação foi de 100,0 mL, e o volume de solução de EDTA 0,0100 mol L-1 gasto na titulação foi de 25,0 mL. Considere o resultado expresso em mg de CaCO3 por 1000 mL e a classificação da dureza da água, presentes na tabela abaixo.

Com base nas equações e na tabela, essa amostra é classificada como água
Com relação à titulação de neutralização de um ácido fraco monoprótico por uma base forte, considere as afirmativas abaixo.
I No ponto de equivalência, o ácido fraco remanesce sem se ionizar.
II No ponto de equivalência, o pH será sempre maior que 7.
III Na metade do volume para o ponto de equivalência, o pH é igual ao pKa do ácido fraco.
IV Após o ponto de equivalência, o pH corresponde ao de uma solução tampão.
Das afirmativas, estão corretas