Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
O processo de aprendizagem, no ensino sobre os ácidos nas Ciências da Natureza, tem início com a abordagem da teoria da ionização e da dissociação iônica de Svant Arrehenius, ganhador do Premio Nobel de Química, em 1903. De acordo com a teoria, ácidos são compostos que, em solução aquosa, se ionizam e, ao se dissolverem em água, conduzem a corrente elétrica, de forma mais intensa, dependendo da força do ácido. Assim, em solução aquosa, os ácidos apresentam condutividade elétrica e podem mudar de cor determinadas substâncias químicas denominadas indicadoras de ácidos.
Tendo em vista essas informações sobre o ensino dos ácidos nas Ciências da Natureza, é correto levar em consideração, no processo de ensino-aprendizagem,
De acordo com as funções inorgânicas, julgue os itens seguintes.
Os nitretos, assim como os carbetos, são utilizados em aplicações nas quais as cerâmicas estruturais iônicas apresentam propriedades mecânicas insuficientes.
De acordo com as funções inorgânicas, julgue os itens seguintes.
A reação de neutralização entre o ácido clorídrico e a amônia gera como produto o cloreto de amônio, sal bastante solúvel em água.
Um perito oficial dissolveu certa quantidade de um sal em solvente e, por alguma perturbação, parte do sal se depositou, produzindo uma solução. Pode-se considerar nominalmente essa solução como:
A reatividade do metal pode ser relacionada com a sua eletropositividade, ou seja, quanto mais eletropositivo for o metal mais reativo ele é. A série ou a fila de relatividade também organiza os elementos com sua capacidade de se oxidar, quanto mais reativo maior é sua capacidade de oxidar-se.
Com base nesta informação, é correto afirmar que o
SIQUEIRA e colaboradores (2013) monitoraram a concentração de Mn, entre outros metais, o longo do curso do Rio Aurá, na Região Metropolitana de Belém. A figura a seguir agrupa os dados obtidos durante esse estudo.
Disponível em: < http://www.scielo.br/scielo.php?script=sci_aettext&pid=S0044-59672013000100007&lng=pt&nrm=1&tlng=pt >. Acesso em 18/09/2013.
Sabendo que a EPA considera não poluído o sedimento com teor de Mn inferior a 300 mg kg-1, moderadamente poluído com concentração entre 300 mg kg-1 e 500 mg kg-1 e altamente poluído com teores acima de 500 mg kg-1, o Rio Aurá, ao longo do trecho investigado, seria classificado, quanto a seu sedimento, como
Texto 5, para as questões 31 e 32
Considerando o modelo de fluxo da figura do texto 5 e que a média de Mn no sedimento, no Rio Aurá, ao longo dos pontos investigados, foi de 441,2 ± 182,5 mg kg-1, aliado ao fato de que a EPA considera não poluído o sedimento com teor de Mn inferior a 300 mg kg-1, é correto formular a hipótese que a coluna d' água do Rio Aurá
A formação frequente de grandes volumes de pirita (FeS2) em uma variedade de depósitos minerais favorece a formação de soluções ácidas ferruginosas, conhecidas como “drenagem ácida de minas”. Esse fenômeno tem sido bastante pesquisado pelos cientistas e representa uma grande preocupação entre os impactos da mineração no ambiente. Em contato com oxigênio, a 25 °C, a pirita sofre reação, de acordo com a equação química:
4 FeS2 (s) + 15 O2 (g) + 2 H2O (I) 2Fe2(SO4)3 (aq) + 2 H2SO4 (aq)
FIGUEIREDO, B. R. Minérios e ambiente. Campinas: Unicamp, 2000.
Para corrigir os problemas ambientais causados por essa drenagem, a substância mais recomendada a ser adicionada ao meio é o
A osmose é a passagem de solvente através de uma membrana semipermeável de um meio para outro meio mais concentrado. Para evitar a osmose e garantir o equilíbrio entre os meios, é necessária a aplicação de uma pressão π (pressão osmótica) no meio mais concentrado. Considere o esquema a seguir, em que volumes iguais de água destilada e de determinada solução aquosa estejam separados por uma membrana porosa permeável ao solvente. Considere, ainda, que foram medidos os valores de pressão osmótica de três soluções aquosas distintas: 1) CH3COOH(aq) 0,010 mol/L; 2) NaOH(aq) 0,010 mol/L e 3) CaCl2(aq) 0,008 mol/L.
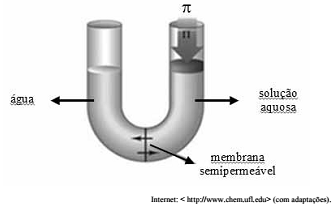
Com base nessas informações e supondo que as soluções
comportem-se idealmente, a ordem crescente das pressões
osmóticas medidas corresponde a
Basicamente, existem dois tipos de pólvora: a pólvora negra e a pólvora sem fumo. Quase todas as armas de fogo modernas usam a pólvora sem fumo. A pólvora negra, classificada como explosivo, é composta por enxofre, carvão e nitrato de potássio. Entre as várias reações que ocorrem na explosão da pólvora negra, a mais simples está descrita pela seguinte equação química:
2KNO3(s) + S(s) + 3C(s) 6 K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item.
Se o gás carbônico reagir com a água para formar o ácido
carbônico, o CO2 receberá um par de elétrons da água, que é
uma base de Lewis.