Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.139 questões
I. As temperaturas de fusão e ebulição servem para identificar e diferenciar substâncias puras das misturas.
II. As propriedades químicas são aquelas que não mudam a identidade de uma substância.
III. Toda matéria é constituída por átomos, moléculas ou íons que estão em movimento constante.
IV. Substâncias como hidrogênio e oxigênio, que são compostas de apenas um tipo de átomo, são classificadas como substâncias elementares ou simples.
verifica-se que estão corretas
(Adaptado de: Revista Pesquisa FAPESP n. 198. Disponível em: http://agencia. fapesp.br/16030. Acesso em janeiro de 2013.)
O óxido citado no texto pode ser classificado como:
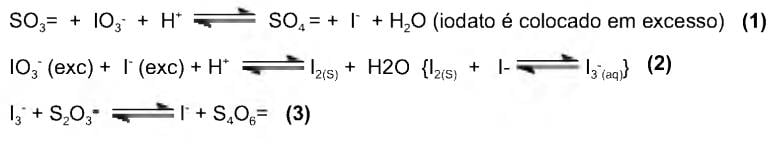
2 S2O32-
 S4O62- + 2e-
S4O62- + 2e-Para proceder a essa análise, é necessária a utilização dos reagentes a seguir, EXCETO.
Mn04- + Fe 2+ + H+ —> Mn 2+ + Fe3+ + H20
Quantos mililitros de uma solução 0,0240 mol L-1 são necessários para titular 20,00mL de uma solução 0,112 mol L-1 em Fe2+ .
1o ) Transfira uma solução padrão de permanganato de potássio 0,5000 mol/L para uma bureta limpa e seca.
2o ) Pipete 25,00 mL de amostra de água oxigenada comercial para um balão volumétrico de 250,00 mL, acrescente água destilada até o traço de referência e faça a homogeneização. Dessa solução, pipete uma alíquota de 25,00 mL para um frasco Erlenmeyer, acrescente ±100 mL de água destilada e 5 mL de ácido sulfúrico concentrado.
3o ) Titule o H2 O2 contido na alíquota com a solução padrão de permanganato de potássio até coloração levemente violeta (1o excesso de KMnO4 ).
A reação que ocorre na titulação é:
2 MnO4 - (aq) + 5 H2 O2(aq) + 6 H+ (aq) → 2 Mn2+ (aq) + 5 O2(g) + 8 H2 O(l)
Seguindo esse roteiro, o volume de solução de permanganato de potássio gasto na titulação da alíquota no frasco Erlenmeyer foi igual a 30,40 mL.
Com base nos resultados da análise, o técnico constatou que a porcentagem massa por volume (g H2 O2 /100 mL água oxigenada) na amostra original é igual a
Dado M(H2O2) = 34,00 g/mol
A massa, em gramas, de PbI 2 , sólido que se forma ao se misturarem 100,00 mL de cada uma das soluções, é
Dados M(KI) = 166 g/mol M(Pb(NO3)2) = 331 g/mol M(Pbl2) = 461 g/mol
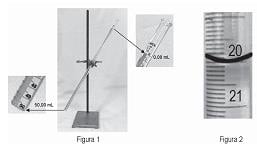
Acrescentou água até a marcação indicada na Figura 2, fez a leitura para chegar ao volume contido e constatou que o valor do erro relativo percentual na medida do volume contido, levando em conta a leitura a partir do menisco inferior, é, aproximadamente,
Soluções Cor da solução na presença Cor da solução na presença Cor da solução na presença
azul de bromotimol de alaranjado de metila de fenolftaleína
1 amarela vermelha —
2 azul amarela —
3 amarela amarela incolor
4 verde — incolor
De acordo com os resultados, o técnico concluiu que as soluções 1, 2 , 3 e 4 eram, respectivamente,
Dados
cores dos indicadores em diferentes faixas de pH (valores aproximados).
Azul de bromotimol Alaranjado de metila Fenolftaleína
pH < 6,0 – cor amarela pH ≤ 3,1 – cor vermelha pH < 8,2 – incolor
pH entre 6,0 e 7,6 – cor verde pH entre 3,2 e 4,4 – cor laranja pH entre 8,2 e 10,0 – cor rosa claro
pH > 7,6 – cor azul pH > 4,4 cor amarela pH > 10 cor rosa intenso
I. As titulações são baseadas em uma reação entre o analito e um reagente padrão.
II. A titulação volumétrica envolve a medida de volume de uma solução de concentração conhecida necessária para reagir completamente com o analito.
III. Na titulação coulométrica, o “reagente” é uma corrente elétrica direta constante de grandeza conhecida que consome o analito.
IV. Em qualquer titulação o ponto de equivalência química, experimentalmente chamado de ponto final, é assinalado pela variação da cor de um indicador ou da resposta de um instrumento.
Estão corretas as afirmativas:
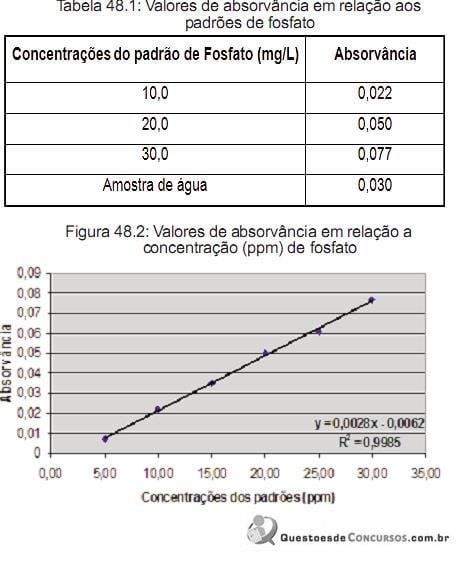
Indique a alternativa que representa o valor em parte por milhão (ppm) da concentração de fosfato na amostra de água.
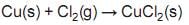
Uma mistura em equilíbrio contém 20 g de Cu, 35 g de Cl2 e 198 g de CuCl2 num recipiente de 2,5 L de capacidade. Identifique a alternativa que apresenta, respectivamente, as concentrações molares (mol/L) do Cu, Cl2 e do CuCl2.
