Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.219 questões
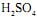 de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada,
de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada, 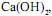 em gramas, igual a
em gramas, igual a  em concentração igual a 0,1 mol/L. Ele tem disponível para isso o sal
em concentração igual a 0,1 mol/L. Ele tem disponível para isso o sal 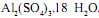 A massa desse sal que o técnico deve utilizar é, em gramas, aproximadamente igual a
A massa desse sal que o técnico deve utilizar é, em gramas, aproximadamente igual a É correto afirmar que na formação, em solução aquosa, de complexos entre íons metálicos Mn+ e EDTA
Sabendo que, para o Cd(OH)2 , a 25 °C, o Kps = 7,2x10–15, a concentração em mol/L de Cd2+que permanece em solução depois do tratamento com NaOH será igual a
Sobre essa solução, é correto afirmar que
Dado: massa molar Mg(NO3 )2= 148 g. mol –1


Com respeito a essa propriedade, o(a)
Com o exclusivo objetivo de neutralizar o ácido, o procedimento correto deve ser o de jogar no asfalto solução aquosa de
1o ) Transfira uma solução padrão de permanganato de potássio 0,5000 mol/L para uma bureta limpa e seca.
2o ) Pipete 25,00 mL de amostra de água oxigenada comercial para um balão volumétrico de 250,00 mL, acrescente água destilada até o traço de referência e faça a homogeneização. Dessa solução, pipete uma alíquota de 25,00 mL para um frasco Erlenmeyer, acrescente ±100 mL de água destilada e 5 mL de ácido sulfúrico concentrado.
3o ) Titule o H2 O2 contido na alíquota com a solução padrão de permanganato de potássio até coloração levemente violeta (1o excesso de KMnO4 ).
A reação que ocorre na titulação é:
2 MnO4 - (aq) + 5 H2 O2(aq) + 6 H+ (aq) → 2 Mn2+ (aq) + 5 O2(g) + 8 H2 O(l)
Seguindo esse roteiro, o volume de solução de permanganato de potássio gasto na titulação da alíquota no frasco Erlenmeyer foi igual a 30,40 mL.
Com base nos resultados da análise, o técnico constatou que a porcentagem massa por volume (g H2 O2 /100 mL água oxigenada) na amostra original é igual a
Dado M(H2O2) = 34,00 g/mol
A massa, em gramas, de PbI 2 , sólido que se forma ao se misturarem 100,00 mL de cada uma das soluções, é
Dados M(KI) = 166 g/mol M(Pb(NO3)2) = 331 g/mol M(Pbl2) = 461 g/mol
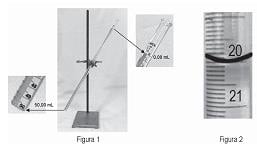
Acrescentou água até a marcação indicada na Figura 2, fez a leitura para chegar ao volume contido e constatou que o valor do erro relativo percentual na medida do volume contido, levando em conta a leitura a partir do menisco inferior, é, aproximadamente,
Soluções Cor da solução na presença Cor da solução na presença Cor da solução na presença
azul de bromotimol de alaranjado de metila de fenolftaleína
1 amarela vermelha —
2 azul amarela —
3 amarela amarela incolor
4 verde — incolor
De acordo com os resultados, o técnico concluiu que as soluções 1, 2 , 3 e 4 eram, respectivamente,
Dados
cores dos indicadores em diferentes faixas de pH (valores aproximados).
Azul de bromotimol Alaranjado de metila Fenolftaleína
pH < 6,0 – cor amarela pH ≤ 3,1 – cor vermelha pH < 8,2 – incolor
pH entre 6,0 e 7,6 – cor verde pH entre 3,2 e 4,4 – cor laranja pH entre 8,2 e 10,0 – cor rosa claro
pH > 7,6 – cor azul pH > 4,4 cor amarela pH > 10 cor rosa intenso
Então, o óxido de potássio, K2O, em água, forma