Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.171 questões
I- Óxidos neutros não reagem com a água.
II- ONa2O reage com ácido formando sal e água.
III-O óxido Cl2O3 pode reagir para formar ácido.
IV-Os óxidos ácidos apresentam ligações covalentes.
Estãocorretas:

O procedimento descrito acima faz as latas de refrigerante gelarem mais rápido do que quando colocadas na geladeira.
Isso se justifica porque a dissolução do álcool em água
A reação que melhor descreve esse processo é
http://www.cebrace.com.br/v2/vidro Acessado em: 08 nov. 2014
Os principais componentes do vidro são
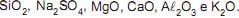
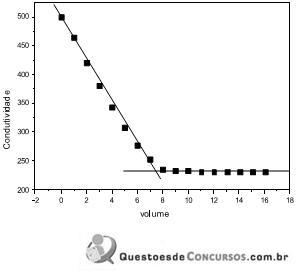
Em ordem crescente de acidez têm-se os óxidos:
A amostra de leite da solução analisada apresentou um valor de densidade de 1,070 g/mL. Sabendo-se que a fórmula química da lactose é C12H22O11, a concentração da lactose (em mol/L) na amostra é de:
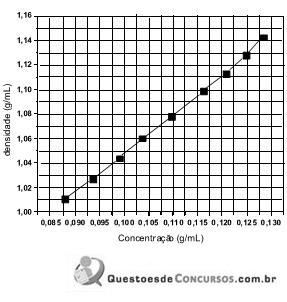
Baseado nestas informações é correto afirmar que:
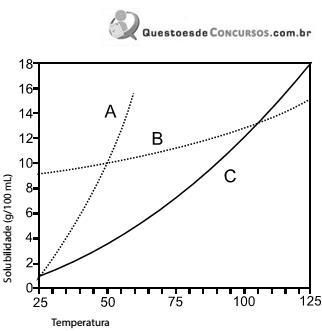
Atente-se que para a primeira reta, a equação obtida foi: y = -23,291 x + 456,64 e para a segunda reta, a equação obtida foi: 231,8.
Baseado nessas informações, é correto afirmar que o volume do ácido necessário para alcançar o ponto de equivalência e a concentração do ácido é respectivamente:
(1) 40 mL de uma solução de NaOH foi totalmente neutralizada com 16 mL de uma solução de HCl.
(2) Depois, 55 mL de NaOH foram adicionados a uma quantidade de matéria de 0,046 mols de ácido acético.
(3) O excesso de NaOH da etapa 2 foi titulada com uma solução de HCl e foram gastos 8,25 mL do ácido até o ponto de equivalência.
Com base nessas anotações, o volume de NaOH necessário para neutralizar 0,046 mols de CH3COOH é de:

Levando em consideração os algarismos significativos, o volume correto lido da proveta é: