Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.139 questões
Uma amostra de 0,265 g de um antibiótico em pó foi dissolvida em HCl e completou-se o volume até 100,00 mL de solução. Uma alíquota de 25,00 mL foi transferida para um balão, seguida da adição de 25,00 mL de solução aquosa 0,018 mol.L–1 de KBrO3. Um excesso de KBr foi adicionado para formar Br2, segundo a equação a seguir: BrO3– + 5Br – + 6H+ → 3Br2 + 3H2O
O bromo formado reage com toda a sulfanilamida presente no antibiótico e, após um tempo, é adicionado excesso de KI, para reagir com o excesso de bromo, formando I2. Finalmente, o iodo formado é titulado, consumindo 13,00 mL de uma solução aquosa 0,12 mol.L–1 de tiossulfato de sódio. As demais equações químicas são:
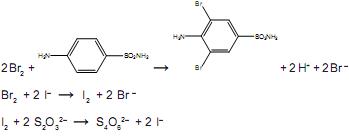
A porcentagem de sulfanilamida presente na amostra do antibiótico em pó é aproximadamente igual a:
Dado: Massa molar da sulfanilamida= 172 g. mol -1
CrCl 3 (aq) + NaOH (aq) + H2 O 2 (aq) → NaCl (aq) + Na2 CrO 4 (aq) + H2 O (l)
Sabendo que foram gastos 50,00 mL de solução básica de CrCl 3 de concentração 0,01 mol.L-1 , a porcentagem em massa (% m) de peróxido de hidrogênio na amostra de água oxigenada é igual a:
Para que se garanta a precisão na molaridade da solução, o ácido clorídrico deverá ser retirado do frasco-estoque por meio de uma pipeta graduada.
As moléculas de sabão formam uma dispersão coloidal que contém agregados esféricos que se aglomeram de modo a formarem uma micela, a qual é solúvel em água e remove sujidades.
I- Óxidos neutros não reagem com a água.
II- ONa2O reage com ácido formando sal e água.
III-O óxido Cl2O3 pode reagir para formar ácido.
IV-Os óxidos ácidos apresentam ligações covalentes.
Estãocorretas:

O procedimento descrito acima faz as latas de refrigerante gelarem mais rápido do que quando colocadas na geladeira.
Isso se justifica porque a dissolução do álcool em água
A reação que melhor descreve esse processo é
http://www.cebrace.com.br/v2/vidro Acessado em: 08 nov. 2014
Os principais componentes do vidro são
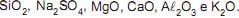
Em ordem crescente de acidez têm-se os óxidos: