Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.139 questões
A massa de bórax necessária para preparar 1L de uma solução a 0,1mol/L é
Os laboratórios de química, de modo geral, são lugares perigosos, principalmente para seus usuários, devido à grande quantidade e diversidade de substâncias químicas neles existentes. A respeito dos cuidados que devem ser adotados nos laboratórios de química, julgue o item que se segue.
Na preparação de uma solução a partir de dois componentes, deve-se adicionar o mais denso sobre o menos denso.
O propeno é muito utilizado, também, na produção do cumeno, por meio da alquilação Friedel-Crafts do benzeno catalisada por HF. A representação dessa reação é mostrada no esquema a seguir.

Com respeito às alquilações Friedel-Crafts e às espécies envolvidas nessas reações, julgue o item que se segue.
De todos os haletos de hidrogênio, o HF é o mais ácido. Esse
comportamento pode ser explicado com base na
eletronegatividade do átomo de flúor, o que estabiliza a base
conjugada do ácido.
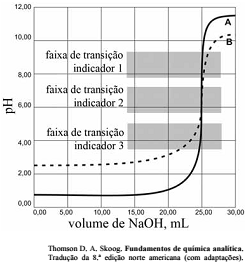
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
A titulação representada pela curva A mostra uma solução mais ácida do que a mostrada pela curva B.
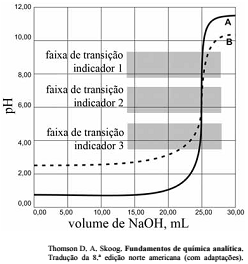
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
A figura mostra a titulação de um ácido fraco com uma base forte.
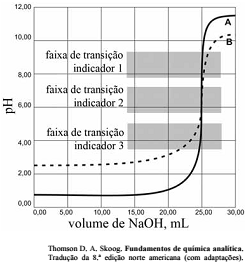
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Soluções padrão de KMnO4 são raramente utilizadas para titular soluções contendo HCl.
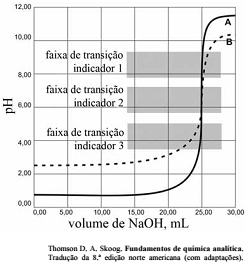
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Nas titulações de complexação, quanto maior for a constante de formação do complexo metal-ligante, melhor a seletividade do ligante para o metal, quando comparadas aos complexos semelhantes com outros metais.
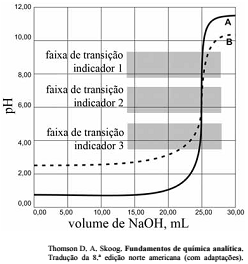
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Qualquer um dos três indicadores ácido base mostrados na
figura podem ser usados para titulação de soluções mais
diluídas.
2KNO3(s) + S(s) + 3C(s) → K2S(s) + N2(g) + 3CO2(g)
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O → NO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
O teor de ferro em dois frascos (A e B) de um medicamento, presente na forma de sulfato ferroso, foi determinado por meio de volumetria de oxidação-redução, utilizando-se KMnO4 0,01 mol/L como titulante, em meio ácido. O frasco A estava lacrado e o frasco B encontrava-se aberto, com menos da metade de seu volume inicial. Para a análise, 5,00 mL do medicamento de cada frasco foram diluídos em água e o volume, completado para 100,00 mL. Em seguida, alíquotas de 30,00 mL das soluções resultantes foram acidificadas com H2SO4 e diretamente tituladas em triplicata com o KMnO4. A tabela abaixo mostra os volumes médios de permanganato gastos e seus desvios padrões em mL.

Com base nessas informações, julgue o próximo item.
Uma solução de amido 1% (m/m) pode ser utilizada como
indicador para essa titulação.
O teor de ferro em dois frascos (A e B) de um medicamento, presente na forma de sulfato ferroso, foi determinado por meio de volumetria de oxidação-redução, utilizando-se KMnO4 0,01 mol/L como titulante, em meio ácido. O frasco A estava lacrado e o frasco B encontrava-se aberto, com menos da metade de seu volume inicial. Para a análise, 5,00 mL do medicamento de cada frasco foram diluídos em água e o volume, completado para 100,00 mL. Em seguida, alíquotas de 30,00 mL das soluções resultantes foram acidificadas com H2SO4 e diretamente tituladas em triplicata com o KMnO4. A tabela abaixo mostra os volumes médios de permanganato gastos e seus desvios padrões em mL.

Com base nessas informações, julgue o próximo item.
A concentração de sulfato ferroso no medicamento do frasco
A é maior que 0,4 mol/L.
O teor de ferro em dois frascos (A e B) de um medicamento, presente na forma de sulfato ferroso, foi determinado por meio de volumetria de oxidação-redução, utilizando-se KMnO4 0,01 mol/L como titulante, em meio ácido. O frasco A estava lacrado e o frasco B encontrava-se aberto, com menos da metade de seu volume inicial. Para a análise, 5,00 mL do medicamento de cada frasco foram diluídos em água e o volume, completado para 100,00 mL. Em seguida, alíquotas de 30,00 mL das soluções resultantes foram acidificadas com H2SO4 e diretamente tituladas em triplicata com o KMnO4. A tabela abaixo mostra os volumes médios de permanganato gastos e seus desvios padrões em mL.

Com base nessas informações, julgue o próximo item.
Considerando a ausência de interferentes, para se determinar
o teor de ferro total em uma amostra de minério, pode-se
utilizar o método de titulação usado para os medicamentos,
desde que um agente redutor auxiliar seja empregado antes da
titulação com KMnO4.
O teor de ferro em dois frascos (A e B) de um medicamento, presente na forma de sulfato ferroso, foi determinado por meio de volumetria de oxidação-redução, utilizando-se KMnO4 0,01 mol/L como titulante, em meio ácido. O frasco A estava lacrado e o frasco B encontrava-se aberto, com menos da metade de seu volume inicial. Para a análise, 5,00 mL do medicamento de cada frasco foram diluídos em água e o volume, completado para 100,00 mL. Em seguida, alíquotas de 30,00 mL das soluções resultantes foram acidificadas com H2SO4 e diretamente tituladas em triplicata com o KMnO4. A tabela abaixo mostra os volumes médios de permanganato gastos e seus desvios padrões em mL.

Com base nessas informações, julgue o próximo item.
A concentração determinada para o frasco B apresentou um
erro sistemático positivo significativo, no nível de 95% de
confiança, em relação à obtida para o frasco A.
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
A redução do nitrato, que consome três moles de elétrons por mol de NO3 – em meio ácido, gera o óxido nítrico, que é um agente complexante mais forte que o íon nitrato
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
Se o gás carbônico reagir com a água para formar o ácido carbônico, o CO2 receberá um par de elétrons da água, que é uma base de Lewis.
2KNO3(s) + S(s) + 3C(s)-> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O -> 6 HNO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
Na determinação volumétrica de ácido fosfórico em um medicamento fortificante e antianêmico, foram anotados os seguintes dados:
– alíquota da amostra analisada = 20,0 mL;
– volume de NaOH, 0,100 mol.L–1 gasto na titulação da amostra = 9,0 mL;
– reação envolvida: H3 PO4 + 3NaOH → Na3 PO4 + 3H2O.
De acordo com os dados da análise, a concentração, em
mol.L–1
, de ácido fosfórico no medicamento é de