Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Sobre a bauxita, que é utilizada como principal fonte de extração do alumínio metálico, analise as afirmativas a seguir e assinale a alternativa correta.
I. É uma mistura de óxidos de óxidos de alumínio, principalmente Al2O3, sendo abundante na natureza.
II. A extração do alumínio metálico, a partir desse óxido, envolve um processo de redução eletroquímica.
III. A dificuldade de extração do alumínio desse material fez com que o alumínio metálico, embora seja o metal mais abundante na crosta terrestre, só passasse a ser utilizado amplamente a partir do século XIX.
Estão corretas as afirmativas:
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

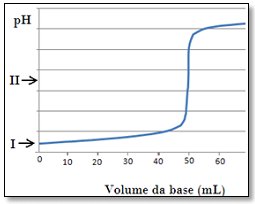
A figura apresentada ao lado representa a titulação para 100 mL de uma solução de HCl com uma solução padrão de NaOH 0,2 mol L-1 .
Os valores de pH indicados pelas setas no gráfico são, respectivamente:
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

As afirmativas a seguir referem-se a reações de neutralização.
I. Sais derivados de ácidos fortes com bases fortes se dissolvem na água para produzir íons H3O+ ou íons OH- .
II. A reação estequiométrica entre um ácido forte e uma base fraca produz uma solução ácida.
III. A reação estequiométrica entre um ácido fraco e uma base forte produz uma solução ácida.
IV. Sais derivados de ácidos ou bases fracas se dissolvem na água para produzir íons H3O+ ou íons OH- .
Dentre as afirmativas, estão corretas apenas
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

A análise volumétrica de uma determinada amostra de um ácido diprótico, com NaOH 0,100 mol L-1 , foi realizada usando-se o seguinte procedimento: inicialmente, coletou-se uma alíquota da amostra com o instrumento (1) indicado na figura ao lado; após a devida aferição de volume, a alíquota foi transferida para o instrumento (2); em seguida, o volume do instrumento (2) foi aferido com água destilada; posteriormente, uma alíquota da solução obtida foi coletada com o instrumento (3), devidamente aferido, e transferida para o instrumento (4), onde adicionou-se um indicador apropriado; ao acionar o instrumento (5), observou-se a mudança da cor da solução titulada após a adição do volume indicado pela seta.
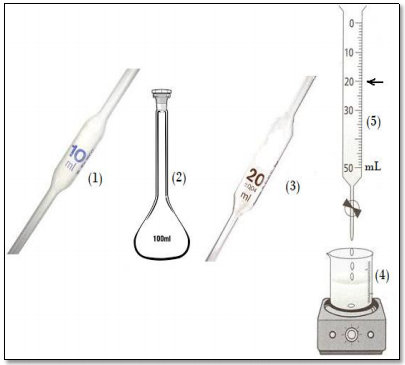
Para a reação envolvida na titulação, devidamente balanceada, o resultado da soma dos coeficientes estequiométricos é
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5


Baseando-se nessa descrição, é correto afirmar que a concentração do ácido na amostra, em mol L-1 , é
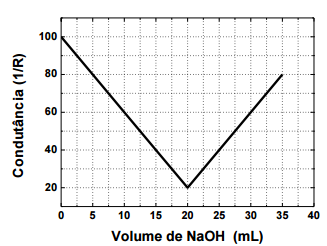

Considerando as medidas de condutância que poderiam ser obtidas para essas soluções, é CORRETO afirmar:
I. O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio. II. A potenciometria é uma técnica eletroanalítica em que se obtêm medidas de potencial geradas por espécies químicas em um meio, sem a necessidade da utilização de um eletrodo de referência. III. A medida do potencial de um eletrodo indicador pode ser utilizada para determinar o ponto de equivalência de uma titulação.
É CORRETO
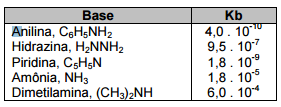
Analisando esses valores, é CORRETO afirmar:
Cr2O72-(aq) + 6Fe2+(aq) + 14H+(aq) -› 2Cr3+(aq) + 6Fe3+(aq) + 7H2O(l)
Considerando a estequiometria dessa reação, a porcentagem em massa de Fe na amostra analisada é, aproximadamente, igual a