Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
O laboratório que está sujeito à norma na questão anterior é um gerador contínuo de resíduos de mercúrio. O tratamento adequado desses resíduos consiste na sua acidificação com ácido nítrico seguido da adição de tioacetamida (CH3SNH2). Esse último sofre decomposição, gerando íons sulfeto em meio ácido.
Dados: M (g.mol-1 ): Hg = 200; S = 32; N = 14; H = 1; KPS: HgS = 2 x 10-53 .
Uma bombona de 20L contém um resíduo de mercúrio em concentração de 0,1 mol.L-1 . Qual é a massa (em gramas) mínima necessária de tioacetamida para tratar esse resíduo?
A titulação redox se baseia numa reação de oxirredução entre analito e titulante. A titulação utilizando permanganato de potássio facilita a visualização, porque a solução do íon permanganato possui cor violeta intensa, enquanto que a solução de Mn2+ é quase que incolor. A solução de permanganato pode ser utilizada para titular solução de íons Fe2+ .
Ao se titular uma alíquota de 10 mL de uma solução 1,1 mol.L-1 de Fe2+, o volume esperado de permanganato 0,100 mol.L-1 a ser consumido é de:
Misturas são classificadas de acordo com o grau de interação entre as fases e seu estado de agregação. Sobre o tema, numere a coluna da direita de acordo com sua correspondência com a coluna da esquerda.
1. Emulsão.
2. Gel.
3. Sol.
4. Solução coloidal.
( ) Hidróxido de cobre hidratado.
( ) Tinta para parede (líquida no galão).
( ) Água natural rica em ácidos húmicos.
( ) Manteiga.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
O etilenoglicol é largamente utilizado como anticongelante automotivo. A temperatura de congelamento, isto é, a temperatura de equilíbrio entre a fase líquida e a sólida diminui na presença de um soluto em relação a um solvente puro.
Dado: Kf = 1,86 ºC.kg.mol-1 .
Para que a temperatura do líquido seja diminuída em aproximadamente 7,5 ºC, a concentração molal de etileno glicol deverá ser de:
A titulação ácido-base é uma das operações mais corriqueiras de um laboratório de análises. Para se preparar e acondicionar uma solução titulante padronizada de hidróxido de sódio, alguns procedimentos são necessários. Acerca da necessidade do procedimento para preparação da solução mencionada acima, considere as seguintes afirmativas:
1. É necessário pesar a massa de hidróxido de sódio sólido em balança analítica.
2. É necessário utilizar balão volumétrico previamente aferido.
3. É necessário pesar biftalato de potássio seco em balança analítica.
4. É necessário utilizar um frasco plástico para armazenamento.
Assinale a alternativa correta.
A classificação e separação das espécies segundo sua função química é uma das atribuições do técnico responsável por um laboratório. Os rótulos nos reagentes importados contêm os nomes originais dos produtos. Nesse sentido, numere a coluna da direita com base na informação contida no rótulo do produto mostrada na coluna da esquerda.
1. Phosphorus pentoxide.
2. Trifluoromethanesulfonic acid, reagent grade.
3. n-Butyllithium solution.
4. Ammonium hexafluorophosphate.
( ) Sal.
( ) Ácido.
( ) Óxido.
( ) Base.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
O íon nitrato é um ânion poliatômico. Possíveis estruturas de Lewis são construídas a partir da fórmula NO3- , como mostradas a seguir:
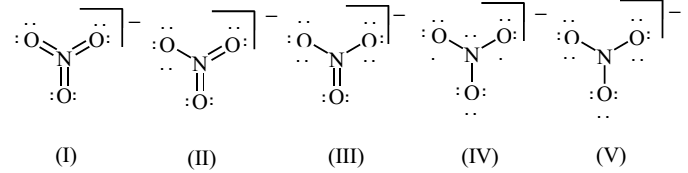
A fórmula de Lewis correta e mais estável do íon nitrato é:
Observe a seguinte reação:
B(CH3)3 + NH3 → B(CH3)3NH3
O composto B(CH3)3 classifica-se como um(a)
Analise a reação química a seguir.
HSO4– + OH– → H2O + SO4–2
Com base na reação apresentada, o ácido de Brønsted e sua base conjugada são, respectivamente,
Numa titulação é preciso saber com precisão quando a solução que está sendo padronizada reagiu completamente com o padrão primário. Sobre o ponto final da reação, analise as afirmativas.
I. Ponto de equivalência ou ponto final teórico corresponde ao ponto da titulação em que é adicionada a quantidade de reagente padrão exatamente equivalente à quantidade de analito.
II. É calculado com base na estequiometria da reação envolvida na titulação.
III. Ponto final é o ponto da titulação onde ocorre uma alteração física associada à condição de equivalência. É indicado pela súbita mudança de alguma propriedade física da solução.
IV. A determinação do ponto final pode ser feita pelo uso de indicadores visuais que causam mudança na cor da solução num ponto muito próximo ao ponto de equivalência.
V. A determinação do ponto final pode ser feita, ainda, por métodos instrumentais e respondem a certas propriedades da solução, que mudam de características durante a titulação, tais como: medida de pH, condutividade, potencial, corrente, temperatura, absorbância etc.
Estão corretas as afirmativas