Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Associe as misturas com suas características.
I – Solução verdadeira
II – Dispersão coloidal
III – Suspensão
P – mistura homogênea na qual não é possível observar o soluto nem com o auxílio de microscópio.
Q – mistura heterogênea na qual o soluto pode ser observado com o auxílio de um microscópio.
R – mistura homogênea na qual o soluto só pode ser observado com o auxílio de um microscópio.
S – mistura heterogênea na qual o soluto pode ser observado sem a necessidade de microscópio.
As associações corretas são:
SnCl2(aq) + 2 FeCl3(aq) → SnCl4(aq)+ 2 FeCl2(aq)
Qual a concentração, em quantidade de matéria (mol/L), da espécie Sn 4+ formada?
HA ⇌ A- + H+ ; Ka = 1,0 x 10-4
A alternativa que indica, com melhor aproximação, a concentração, em mol L-1 , de íons H+ na solução é:
I – Ao se dissolver acetato de sódio em água, tem-se uma solução na qual [OH- ] < [H+]
II – O produto de solubilidade do cloreto de chumbo (II) é dado pela expressão: Kps = [Pb+] [Cl- ].
III – Os sais são substâncias de caráter iônico.
Está correto APENAS o que se afirma em
O valor mais próximo da massa, em gramas, de K2 Cr 2 O7 presente em uma alíquota de 25,00 mL dessa solução é
Dado M(K2Cr2O7) = 294 g/mol
Dado MM(NaOH) = 40 g/mol
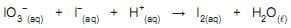
Nessa reação, o
É uma propriedade da função química inorgânica:
I. A densidade também pode ser considerada como sendo 9,00.102 g/L.
II. Se um rótulo informa que tem 50,0Kg de etilenodiamina, então, o volume da embalagem tem que ser maior do que 100L.
III. É possível considerar que o teor de etilenodiamina é 90,0%(m/v).
IV. A concentração da solução de etilenodiamina pode ser considerada como sendo 15,0mol/L.
É correto o que se afirma em
Equação 1:
NH4 + (aq) + OH- (aq)
 NH3(aq) +H2O(l)
NH3(aq) +H2O(l) Equação 2:
HSO4 - (aq) + HCO3-(aq)
 SO4 2- (aq) + H2CO3(aq)
SO4 2- (aq) + H2CO3(aq) São pares de base e base conjugada de Bronsted-Lowry, respectivamente, em cada equação:
Na2S2O3(aq)+ I2(aq) → Na2S4O6(aq)+ NaI(aq)
Diante do exposto, assinale a alternativa que apresenta a concentração de iodo presente na solução estoque.
Os íons de maior e de menor prioridade de descarga são, respectivamente,
NaHCO3(s) + HC2 H3 O2(aq) → NaC2 H3O2(aq) + H2 O(l) + CO2(g)
Nessa reação, o
Dado Massa molar do NaOH = 40 g/mol
Nessas condições, a concentração de NaOH, em g/L, na solução comercial é
• seu cátion corresponde ao elemento químico de maior raio atômico do bloco s da tabela de classificação periódica dos elementos;
• seu ânion corresponde ao elemento químico de maior energia de ionização do grupo VIIA da tabela de classificação periódica dos elementos.
A fórmula mínima desse sal é