Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.139 questões
Os principais diagramas de classificação química das águas subterrâneas (Piper, Stiff e Schoeller) apresentam a concentração dos principais elementos em mg/L.
íons identificação nitrito I nitrato II sulfito III sulfato IV
O íon em que o átomo central apresenta conjunto de orbitais híbridos sp2 e o íon que apresenta geometria pirâmide trigonal são identificados na tabela, respectivamente, com os números
Dados: Densidade do etilenoglicol: 1,1 g cm-3 .
Densidade da água: 1,0 g cm-3
Kf = 1,9 K mol -1 Kg
H = 1 g mol -1 ; O = 16 g mol -1 ; C = 12 g mol -1
Dados:
Capacidade calorífica da água: 1 cal.g-1 . o C-1 .
Capacidade calorífica da solução neutralizada:1 cal.g-1 . o C-1 .
Densidade da água e de todas as soluções envolvidas: 1g.mL-1 .
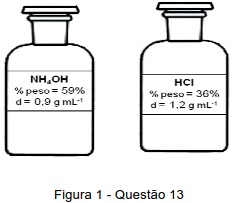
De acordo com as previsões do estudante, para produzir a quantidade de gás hidrogênio desejada ele deverá utilizar 500 mL de uma solução 6 mol L-1 preparada a partir de um dos reagentes acima. Indique a alternativa onde são apresentados, respectivamente, a identidade e o volume do reagente concentrado que o estudante deverá utilizar.
Dados: H = 1 g mol -1 ; N = 14 g mol -1 ; O = 16 g mol -1 ; Cl = 35,5 g mol -1 ; Zn = 65,4 g mol -1 .
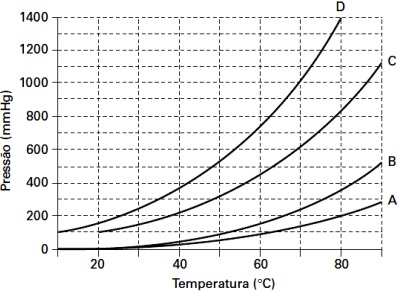
Figura 1 – Questão 11: Variação da pressão de vapor em função da temperatura para quatro diferentes substâncias puras.
Substância Massa Molar g mol-1 CHCl3 (Clorofórmio) 119,5
H2O (água) 18 CH3CH2OH (etanol) 46 CH2(OH)COOH (ácido glicólico) 76
As curvas apresentadas no gráfico foram obtidas em experimentos utilizando as substâncias listadas na Tabela 1. Identifique a alternativa que associa corretamente as curvas do gráfico às suas respectivas substâncias.
As curvas apresentadas no gráfico foram obtidas em experimentos utilizando as substâncias listadas na Tabela 1. Identifique a alternativa que associa corretamente as curvas do gráfico às suas respectivas substâncias.
Dado: caminho óptico (b)= 1cm
Lei de Lambert-Beer A = ε b. c