Questões de Concurso
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 401 questões
O processo de titulação é usado em técnicas de determinação volumétrica e consta, basicamente, da adição de uma solução padrão, gota a gota, a uma amostra sob agitação constante. Em relação ao processo de titulação, analise:
I- Quando o ponto final é indicado pelo aparecimento de uma turvação, é recomendável fazer a visualização contra um fundo branco;
II- A solução contendo o constituinte a determinar é transferida para um frasco Erlenmeyer ou similar;
III- Esta técnica é realizada com o auxílio de uma bureta e o ponto final da reação é dado através da visualização da mudança de coloração de um indicador adequado ou através de um medidor de pH.
Dos itens acima:
A alcalinidade é definida como a capacidade da água em neutralizar ácidos. Pode ser atribuída à presença de carbonatos e bicarbonatos provenientes da ação erosiva da água sobre os solos e rochas. Pode se dizer em relação a alcalinidade:
(__)- A alcalinidade da água é causada por íons: OH- = Hidróxido, HCO3 = Bicarbonato e CO3 = Carbonatos;
(__)- Os reagentes utilizados na determinação da alcalinidade são: Metil orange - 4 gotas, Fenolfetaleina – 10 gotas e Ácido Sulfúrico N/25;
(__)- Se não der coloração com a fenolfetaleina é porque não há alcalinidade a fenolftaleina;
(__)- A alcalinidade da água serve para reagir com o sulfato de alumínio.
Julgue os itens acima em verdadeiro (V) ou falso (F) e, em seguida, assinale a alternativa contendo a ordem correta das respostas, de cima para baixo:
O tratamento convencional remove partículas em suspensão, microrganismos e partículas coloidais. A remoção destas partículas se dá através dos processos de coagulação, floculação e decantação. As reações químicas envolvidas no tratamento se processam, principalmente, na etapa de coagulação. Ocorre a reação do sulfato de alumínio com a água, formando várias espécies químicas. Assinale a alternativa incorreta que não representa uma formação espécies química após a reação mencionada.
A _____________ é uma solução de concentração exatamente conhecida, que é indispensável para realizar análises volumétricas. É a solução que será usada para comparação das concentrações.
Assinale a alternativa que preenche corretamente a lacuna acima.
O ácido sulfídrico é um:
O (a) ______________ é um ácido tóxico e corrosivo, utilizado na produção de fertilizantes e de compostos orgânicos.
Marque a alternativa que responde corretamente a lacuna acima.
As afirmativas de 1 a 5 tratam das vantagens (V) e desvantagens (D) de uma titulação potenciométrica em relação à titulação com indicador visual. Escolha a resposta correta.
1 – dispensa uso de indicadores, eliminando erros.
2 – requer maior custo da análise.
3 – realiza titulações em meio não aquoso.
4 – Requer aparato especial (potenciômetro, eletrodo indicador e de referência).
5 – pode ser usada em condições turvas e fortemente colorida.
O padrão primário é uma substância extremamente importante em química analítica laboratorial e é usada como material de referência em titulações. Assinale a alternativa INCORRETA em relação ao padrão primário:
O professor de um laboratório químico solicitou ao seu técnico que preparasse uma solução aquosa de uma base forte, no caso Ca(OH)2. Ele exigiu que a solução tivesse a concentração 0,0011 mol/L. Para essa solução podemos afirmar que o pH vale: (Assuma log 2,2 = 0,34).
A alternativa correta em relação às funções químicas dos compostos listados é:
K3[Fe(CN)6] (NH4)2Cr2O7 Fe2O3 HClO4 Zn(OH)2
Dentre os metais alcalinos (metais do grupo 1 da tabela periódica), qual apresenta a menor primeira energia de ionização?
Relacione a Coluna 1 à Coluna 2, associando as classes de qualidade dos solos às respectivas concentrações de substâncias químicas.
Coluna 1
1. Classe 1.
2. Classe 2.
3. Classe 3.
4. Classe 4.
Coluna 2
( ) Solos que apresentam concentrações de pelo menos uma substância química maior que o VP e menor ou igual ao VI.
( ) Solos que apresentam concentrações de pelo menos uma substância química maior do que o VRQ e menor ou igual ao VP.
( ) Solos que apresentam concentrações de pelo menos uma substância química maior que o VI.
( ) Solos que apresentam concentrações de substâncias químicas menores ou iguais ao VRQ.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Um estudante estava com muita dificuldade para aprender sobre as reações de neutralização e pediu ajuda a um amigo, técnico em laboratório. Depois de algumas horas de discussão e explicações, o amigo técnico resolveu testar o estudante apresentando-lhe 5 (cinco) reações e questionando-o: Qual destas reações se caracteriza como reação de neutralização parcial? O estudante analisou as 5 (cinco) reações e, em poucos minutos, respondeu convicto. Considerando que os itens abaixo apresentem as reações indicadas pelo técnico, amigo do estudante, e que este tenha respondido corretamente, assinale qual das seguintes reações ele indicou como resposta.
Como deve ser neutralizada uma solução ácida antes do descarte?
As reações químicas são o resultado de ações entre substâncias que geralmente formam outras substâncias. Assim, as moléculas presentes nessas substâncias sofrem alterações gerando novas moléculas. Elas ocorrem em velocidades diferentes como, por exemplo, no processo de digestão dos alimentos que leva algumas horas. Marque a opção que indica uma reação instantânea de
Considere os ácidos abaixo

Um estudante prepara soluções aquosas desses ácidos com a mesma concentração molar. Sobre esses ácidos e as
espécies presentes nas soluções, é correto afirmar que:
As aminas secundárias são bases fortes de Lewis. A dimetilamina (CH3 )2 NH, possui um pKb de 5,4.10-4 (fonte: J. Magalhães, Elementos 11º ano, Santillana, Carnaxide, 2008). Qual o pH, aproximado, de uma solução 0,3 mol.L-1 de dimetilamina, em água?
Dados: log1,264 = 0,102; 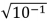 = 0,316.
= 0,316.
Algumas propriedades só dependem do número relativo de partículas de soluto e solvente que estão em solução, ou seja, não dependem da identidade química do soluto. Sendo assim, assinale a alternativa que apresenta algumas dessas propriedades.