Questões de Concurso
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 373 questões
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.
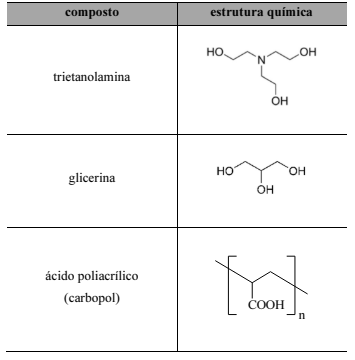
Em solução fortemente ácida, os grupos carboxila do carbopol encontram-se majoritariamente ionizados.
Dados: N (Z=7); O (Z=8)
O SO2 (g) é um óxido ácido.
Na reação apresentada no texto, o ácido H2S é o agente oxidante.
Conforme a definição de Brønsted-Lowry, um ácido, tal como o H2S, é uma espécie que libera íons H+ em solução aquosa.

Com base nessas informações, julgue o próximo item.
Nessa reação, a dipirona atua como uma base de
Brønsted-Lowry.
Entretanto, observa-se que, contrário à regra, os valores daprimeira energia de ionização dos átomos nitrogênio (Z = 7) eoxigênio (Z = 8) mostram EI(O) < EI(N):
• EI(N) = 1402 kJ mol-1 • EI(O) = 1314 kJ mol-1
Assinale a opção que justifica corretamente a relação entre osvalores de EI do nitrogênio e do oxigênio.
I. Energia de dissociação (kJ mol-1 ): H2 = 424, N2 = 932, F2 = 146, Cl2 = 230
II. Energia de dissociação (kJ mol-1 ): C-C = 348, C=C = 612, C≃C (benzeno) = 518, C≡C = 837
Sobre as energias de dissociação, assinale a alternativa incorreta.
NH3(g) + H2O(ℓ) ⇄ NH4+(aq) + OH-(aq)
Com relação à amônia e a sua reação com água, analise os seguintes itens:
I. A geometria molecular da amônia é piramidal. II. A amônia é dita como base de Bronsted-Lowry na reação com a água. III. NH4+ é a base conjugada da amônia.
Assinale a alternativa que contém a análise correta.
A respeito de conceitos de química orgânica, julgue o próximo item.
Os ácidos são doadores de nêutrons e as bases são receptoras de prótons, segundo Brønsted e Lowry.
A dissociação iônica ocorre quando os íons que já existem nas substâncias se separam em solução aquosa nos seus respectivos cátions e ânions. Esse processo é característico de compostos iônicos, como é o caso do sal cloreto de sódio:

Considere as soluções aquosas a seguir, todas de concentração 0,1 mol/L.
NH4OH (Kb = 1,8 × 10−5)
H3CCOOH (Ka = 1,8 × 10−5)
HF (Ka = 3,5 × 10−4)
HCN (Ka = 4,9 × 10−10)
HCℓO4 (Ka = 2,0 × 107)
O menor pH e a menor condutibilidade elétrica são observados, respectivamente, nas soluções de:
Um professor demonstrou aos seus alunos o experimento para identificar a natureza das ligações de algumas substâncias. Submeteu a um teste de condução de corrente elétrica alguns materiais no estado sólido e após dissolvê-los em água destilada, como segue.
Frasco I: sal de cozinha.
Frasco II: açúcar.
Frasco III: solução aquosa obtida com o material do frasco I.
Frasco IV: solução aquosa obtida com o material do frasco II.
Frasco V: água destilada com a qual preparou as soluções III e IV.
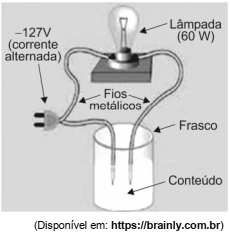
A condução de corrente elétrica capaz de acender a lâmpada é observada somente no frasco
A respeito de ácidos e bases, julgue o item a seguir.
Quando uma espécie ganha um próton, torna-se a base
conjugada.
A respeito de ácidos e bases, julgue o item a seguir.
Quanto mais forte for a base, mais fraco será o seu ácido
conjugado.