Questões de Concurso
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 385 questões
(Disponível em <http://www.epa.gov/lead/learn-about-lead> Acesso em:26 fev. 2016.)
Assinale a equação iônica simplificada que representa CORRETAMENTE a reação que ocorre quando as soluções de Pb(ClO3)2 e Na2SO4 são misturadas:
Soluções aquosas dos sais cianeto de sódio (NaCN) e cloreto de
amônio (NH4C ) apresentam pH
) apresentam pH
Hcl↔H+ + Cl- (K = 1,0.10 +7)
H2SO4 ↔H+ + HSO4 - (Ka = 1,0.10 +3)
H2CO3 ↔H+ + HCO3 - (Ka = 4,3.10 -7)
I - O ácido clorídrico é o que apresenta maior ionização. II - O ácido carbônico é um ácido mais forte que o ácido sulfúrico. III- A ordem de acidez para essas substâncias é HCl > H2SO4 > H2CO3 IV - O ácido sulfúrico possui uma maior tendência em liberar íons H+ que o ácido clorídrico.
Estão corretas:
O modelo mais tradicional considera como ácido uma substância que libera o íon H+ e como base uma substância que libere o íon OH-. No entanto, esse modelo não contempla a neutralização de ácidos por moléculas que não contenham o íon OH-, como no caso da reação da amónia com o ácido clorídrico:
HCI(g) + NH3(I) ⇄ NH4+ + Cl-
O modelo de Lowry-Bronsted altera este modelo, de forma a abranger reações como a acima. Assinale a alternativa que corresponde a essa nova definição.
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

As afirmativas a seguir referem-se a reações de neutralização.
I. Sais derivados de ácidos fortes com bases fortes se dissolvem na água para produzir íons H3O+ ou íons OH- .
II. A reação estequiométrica entre um ácido forte e uma base fraca produz uma solução ácida.
III. A reação estequiométrica entre um ácido fraco e uma base forte produz uma solução ácida.
IV. Sais derivados de ácidos ou bases fracas se dissolvem na água para produzir íons H3O+ ou íons OH- .
Dentre as afirmativas, estão corretas apenas

Considerando as medidas de condutância que poderiam ser obtidas para essas soluções, é CORRETO afirmar:
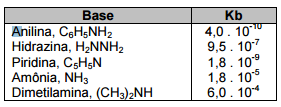
Analisando esses valores, é CORRETO afirmar: