Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
O gráfico a seguir apresenta a entalpia de combustão, em certa temperatura, para o etano, o propano, o butano, o pentano e o hexano.

A energia de dissociação de ligação é uma medida da força da ligação química. É definida como a mudança de entalpia padrão observada na quebra homolítica de uma ligação a 0 K. A inclusão de correções térmicas leva os valores de energia de dissociação à entalpia padrão de dissociação, definidos a 298 K.
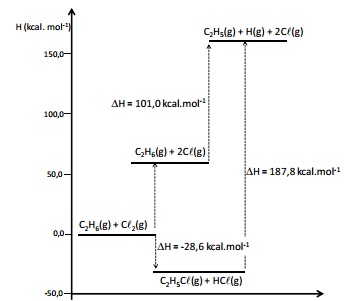
O diagrama de energia a seguir apresenta as variações de entalpia, a 298 K, para diversos processos.
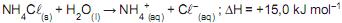
A adição de 1.000 g de cloreto de amônio a 1.000 mL de água, a 20 o C, envolve a variação de entalpia, em kJ, igual a
Dado
MNH4Cl = 53,5g mol -1
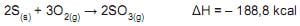
Considerando-se que há excesso de oxigênio e que ocorre reação completa, o valor do calor, em kcal, liberado na formação de 10 mol de SO 3(g) é
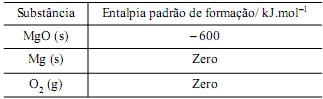
Com base nesses dados, podese afirmar que a combustão completa de 4,86 g de magnésio metálico
A energia necessária para levar o gelo até a temperatura de fusão e a energia necessária para fundir o gelo, são, em J, respectivamente,
Considere
cgelo = 2,2 J/g K
LF =330 J/g
Qual é, em J, a energia retirada para congelar os 100 g de água?
Dados
Lfusão = 336 J/g
cágua = 4,2 J/g.° C
3C2 H 2(g)? C6 H 6( L ) ?Ho = - 502 kJ (I)
2C(grafite)+ H2(g)? C2H2(g) ?Ho = - 215 kJ (II)
Com essas informações, a variação da entalpia de formação do benzeno, em kJ, a partir de C(grafite)e H2(g) é, aproximadamente,
Um sal AX2 formado pelos íons A2+ e X– tem produto de solubilidade, a uma dada temperatura, igual a 4,00 x 10– 18. A concentração máxima, em mol.L– 1, dos cátions A2+ em solução nessa temperatura, é igual a
Uma determinada enzina que causa deterioração de alimentos pode ser inativada, e sua inativação obedece a uma cinética de primeira ordem. Para inativar 99,9% dessa enzima a uma dada temperatura, são necessários dois minutos. A constante de velocidade do processo de desativação da enzima, em min– 1, a essa temperatura, é igual a
Dado: ln 10 = 2,30Qual dos tratamentos termoquímicos dispensa tratamento térmico posterior?
Hidrogênio é um combustível muito utilizado em motores de propulsão aspirada hipersônicos devido ao elevado impulso específico que ele gera numa reação química com oxigênio, o que permite números de Mach em voo maiores do que os alcançados com o uso de hidrocarbonetos. Contudo, hidrocarbonetos, principalmente metano e seus derivados como a querosene, ainda são muito populares, principalmente devido à sua baixa densidade. Qual é a outra razão importante para essa popularidade?
Quando 0,400 g de NaOH são dissolvidos em 100,0 mL de água, a temperatura sobe de 25 °C a 26,03 °C. Calcule a quantidade de calor (q) e o ΔH para o processo de dissolução. Dados: calor específico da água (CE) = 4,18 J/g °C.
Um folheto explicativo sobre uma máquina térmica afirma que ela, ao receber 1000 cal de uma fonte quente, realiza 4186 J de trabalho. Sabendo que 1 cal equivale a 4,186 J e com base nos dados fornecidos, pode-se afirmar que esta máquina
entalpias padrão de combustão:
benzeno (C6H6 (l)): – 3268 KJ
ciclohexano (C6H12 (l)): – 3902 kJ
entropias molares padrão : :
H2O (l): 75 J K-1 mol-1
H2 (g): 131 J K-1 mol-1
O2 (g): 205 J K-1 mol-1
Reações:
(I) H2 (g) + ½ O2 (g) → H2O (l) (entalpia padrão de reação = - 286 kJ)
(II) C6H6 (l) + 3 H2 (g) → C6H12 (l)
Considerando as informações acima, julgue os itens subsequentes, relacionados a conceitos de termoquímica.
A fim de prever se uma reação é espontânea, deve-se considerar tanto a entropia do sistema quanto a entropia das vizinhanças. Com base nesse fundamento, a reação I é classificada como não espontânea.
O depósito ferrífero da Serra dos Carajás é a maior reserva de minério de ferro do mundo. Sabe-se que, para a reação de 2 mols de ferro, 2Fe + 1,5O2 -> Fe2O3, em um sistema cilíndrico com êmbolo móvel, é necessário remover 831,08 kJ de calor do sistema de modo a manter a temperatura constante e igual a 25 ºC. O peso do êmbolo e a pressão externa mantêm a pressão interna do conjunto constante e igual a 1,0 bar. É importante considerar que: 1- o sistema (oxigênio + Fe) está em repouso; 2- tanto o Fe como o Fe2O3 são sólidos, portanto pode-se considerar despreziveis os volumes ocupados por eles; 3- o comportamento do oxigênio é ideal.
Nessas condições, o valor de W do sistema foi calculado em -3,72KJ e ΔU em -827,36 KJ. Interpretando esses valores, é correto afirmar que
Abaixo está representada a reação de combustão do metanol:
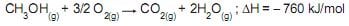
Na combustão completa de 1,0 L de metanol, no estado gasoso, a quantidade de energia liberada, em kJ, é, aproximadamente, igual a