Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
H2O(g) → H2(g) + ½ O2(g) ΔHo = 285 kJ
Nessa reação,
Numa viagem de 200 km, com o carro consumindo, na média, 10 km/L, ao concluir esse percurso, a quantidade máxima de energia liberada, em kJ, será, aproximadamente, igual a
Dados: M (CH3 CH2 OH) = 46 g/mo
CH3 CH2 OH(
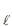 ) + 6 O2 (g) → 2 CO2 (g) + 3H2 O(
) + 6 O2 (g) → 2 CO2 (g) + 3H2 O(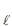 ) ΔH° = -1.400 kJ
) ΔH° = -1.400 kJSe 9,2 kg de etanol são queimados de forma completa, e o calor liberado é aproveitado com 90% de eficiência, a energia útil, em kJ, no processo, é
Portanto,
Esse elemento e esses produtos são, respectivamente,
Hg(l) + ½ O2(g) → HgO(s)ΔH = - 90KJ.mol -1
na formação de 72g de HgO(s), ocorre
Dados: Hg = 200; O = 16
Considere a gasolina comercial como sendo constituída de 25%, em volume, de etanol (CH 3 CH2 OH) e 75%, em volume, de octano (C8 H18 ), e as equações termoquímicas a seguir.
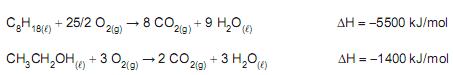
O valor que mais se aproxima do calor (em kJ, na pressão constante de 1 atm) produzido pela queima de 1,00 L de gasolina comum é
Dados
(CH3 CH2 OH) = 46 g/mol
(C8 H18) = 114,2 g/mol
dCH3CH2OH = 0,80 kg/L
dC8H18 = 0,70 kg/L
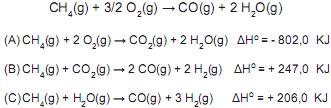
2AL(s)+Fe2O3(s) →Al2O3(s)+2Fe(s)
Qual é o calor de reação do Al2O3 (s) e qual é a classificação da reação quanto ao calor calculado?
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Dados: Ligação Energia de ligação (∆H) C – H 412 kJ/mol C – Cl 432 kJ/mol Cl – Cl 230 kJ/mol H – Cl 419 kJ/mol
Considerando que o rompimento de ligação é um processo endotérmico e que a formação de ligação é um processo exotérmico, qual a variação de entalpia, em kJ/mol, dessa reação?
A entalpia de formação do CS 2(l) a partir de seus elementos formadores tem ΔH = _____________ sendo, portanto uma reação _______________. Assinale a alternativa que contém os complementos corretos para a frase acima, respectivamente.
Dados:
Capacidade calorífica da água: 1 cal.g-1 . o C-1 .
Capacidade calorífica da solução neutralizada:1 cal.g-1 . o C-1 .
Densidade da água e de todas as soluções envolvidas: 1g.mL-1 .
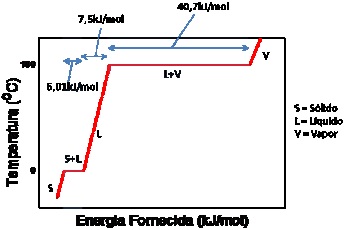
Figura 1 – Questão 12: Curva de aquecimento da água pura. (Adaptado). Fonte: Atkins, P. Jones, L. Chemistry, Molecules, Matter and Change. 4th ed. W. H. Freeman and Company. New York, 1999.
O mínimo de energia necessário para passar 1g de água do estado sólido para o estado vapor é: Dados: H= 1 g mol -1; O = 16 g mol -1
I - N+ O2(g) →2 NO(g)- 43,0 kcal
II - 2P(s)+ 5Cl2(g) → 2PCl5(g)+ 190,8 kcal
III - 2Fe(s) + O 2(g) → 2 FeO(s) ΔH = - 64,04 kcal
São reações exotérmicas
Definindo-se a dependência: h = h(s,p), a seguinte expressão é obtida:

O balanço de massa global na coluna e os valores das
entalpias específicas das correntes da envoltória global
são dados na tabela a seguir.

A carga térmica removida pela água de resfriamento no
condensador é de 4,2 GJ/h.