Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
De forma geral, o fluxo de energia ocorre do maior potencial para o menor potencial; consequentemente, um corpo quente ende a esfriar-se ao ser posto em um ambiente mais frio que ele.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2H2 O(l); ΔH= -890,4 kJ
Com base na informação representada, constata-se que o(a)
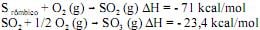
Considerando essas equações químicas, julgue os itens seguintes.
As reações de formação dos óxidos de enxofre são endotérmicas.
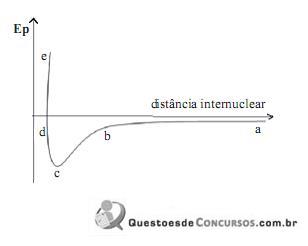
O ponto da curva relacionado com o comprimento da ligação química está representado pela letra:
CCl3 CHCl2 (g) + 2 HF(g) → CCl 3 CHF2 (g) + 2 HCl(g)
Utilizando as energias de ligação médias:
Ligação Energia de Ligação (kJ.mol–1)
C–Cl 338
C–F 484
H–F 565
H–Cl 431
A variação de entalpia da reação apresentada, em kJ.mol–1 , é igual a:
K (s) + 1/2 Cl2(g)
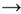 KCI(s)
KCI(s) 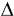 H = -424,2 kJ/mol
H = -424,2 kJ/molO ciclo de Born-Haber para essa reação é constituído por cinco etapas:
Etapa 1: conversão de K(s)em K(g) ;
Etapa 2: dissociação de 1/2 mol de Cl2(g) em átomos isolados de Cl(g).
Etapa 3: ionização de um mol de átomos de K(g) .
Etapa 4: adição de um mol de elétrons a um mol de átomos isolados de Cl(g).
Etapa 5: combinação de um mol de íons K+(g) e um mol de íons Cl-(g) dando origem à formação de um mol de KCI(s) .
Das etapas acima, são exotérmicas apenas:
 H0c), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. A Tabela 68 apresenta a relação entre alguns combustíveis.
H0c), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. A Tabela 68 apresenta a relação entre alguns combustíveis.
Neste contexto, indique qual dos combustíveis, quando queimado completamente, libera mais dióxido de carbono no ambiente pela mesma quantidade de energia produzida.
O.uando 0,5 mol de etanol líquido sofre combustão sob pressão constante, produzindo CO2 e H2O gasosos, a energia liberada é de 148 kcal. Na combustão de 3,00 mols de etanol, nas mesmas condições, será de________ e a entalpia dos produtos, em relação à dos reagentes, é______________
Uma transformação química será exotérmica quando a quantidade de energia__________ na__________ das ligações entre os átomos dos reagentes for menor do que a quantidade de energia________ na __________das ligações entre os átomos dos produtos.
I. Dióxido de carbono sólido (gelo seco) → dióxido de carbono gasoso.
II. Ferro fundido → ferro sólido.
III. Água líquida → vapor d'água.
Dessas transformações, no sentido indicado e à temperatura constante, apenas:
A equação química acima descreve a queima do gás metano, uma reação de combustão muito utilizada na indústria. A partir dessas informações, julgue os itens a seguir.
Considere os tipos de convecção abaixo.
CFG - convecção forçada de gases
CFL - convecção forçada de líquidos
CNG - convecção natural de gases
CNL - convecção natural de líquidos
Sabe-se que, para cada tipo de convecção apresentada, o coeficiente de transferência de calor possui um limite superior diferente.
Usando os valores desses limites superiores para ordenar, em ordem crescente, os tipos de convecção, tem-se
Uma barra de comprimento inicial L0, após aquecida, apresenta um comprimento L, maior que seu comprimento inicial.
A dilatação da barra é tanto maior quanto
A escala de temperatura Fahrenheit define as temperaturas do ponto de gelo e do ponto de vapor, respectivamente, como
Dois tratamentos térmicos aplicáveis somente em aços transformáveis, ou seja, quando se envolve transformação de fase a partir da austenita, são a(o)
Uma expedição de pesquisa chega a um local ermo. Os pesquisadores descobrem que levaram o termômetro errado para medir a temperatura ambiente. Ele havia sido graduado em uma escala X que, em água fervente a 1 atm, indica 80 °X e que, em gelo fundente a 1 atm, indica 30 °X.
Qual a temperatura em °C que esse termômetro mede quando indica 40 °X?Quando se dissolve cloreto de amônio (NH4Cl) em água, a temperatura da solução formada diminui, pois a dissociação desse sal é um processo endotérmico. A variação de entalpia (calor de reação à pressão constante) na dissolução de 1 mol de NH4Cl é igual a 15 kJ.
Se a preparação de uma solução aquosa desse sal produziu 3 kJ, medidos em um calorímetro, a massa, em gramas, dissolvida foi
Dado:
MMcloreto de amônio= 53,5 g/mol
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔHo = − 890kJ
A energia elétrica proveniente de biomassa é uma alternativa amplamente utilizada por grandes empresas do agronegócio nas regiões sul e sudoeste. A energia produzida não somente atende às necessidades dos empreendimentos, como também é vendida a concessionárias na região. A fermentação de restos de vegetais e de dejetos de animais coletados nas fazendas de pecuária e de suinocultura é processada em biodigestores e produz biogás, uma mistura gasosa de metano, CH4(g), sulfeto de hidrogênio, H2S(g) e dióxido de carbono, CO2(g), dentre outros gases, e resíduos ricos em bionutrientes usados como fertilizantes na propriedade rural. A combustão do metano, mostrada pela equação química, libera calor utilizado na geração de energia elétrica.
De acordo com essas informações sobre o processo de
geração de energia a partir de biomassa, e
considerando-se o calor específico da água 4,2Jg−1
K−1
, é
correto afirmar: