Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
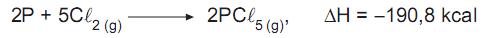
A equação termoquímica acima representa a reação de formação do elemento
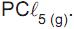 Qual o calor de formação desse elemento?
Qual o calor de formação desse elemento?
Com base nessas informações, julgue os itens que se seguem.
Caso, na reação acima, a coloração amarela torne-se mais intensa ao se aumentar a temperatura do sistema, é correto concluir que a reação será endotérmica no sentido da formação de
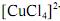 .
. 
Considerando as informações acima e que todos os gases envolvidos sejam ideais, julgue os itens a seguir.
Na equação abaixo, se expressa, corretamente, a quantidade de calor (q) necessária para elevar, a pressão constante, a temperatura de um mol de
 de 298 K até uma temperatura
de 298 K até uma temperatura

Considerando as informações acima e que todos os gases envolvidos sejam ideais, julgue os itens a seguir.
A capacidade calorífica molar, a volume constante, do
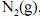
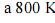 , é maior que
, é maior que 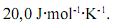 .
. 

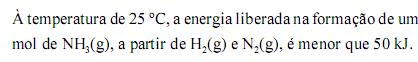

A geometria planar da molécula de amônia é responsável pelo seu elevado calor de vaporização.

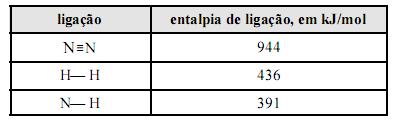
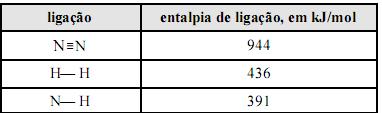
Considere que a amônia (NH3), largamente empregada como gás refrigerante, em razão de seu elevado calor de vaporização, pode ser obtida a partir da reação 3H2(g) + N2(g) 2NH3(g). Considere, ainda, a tabela acima, em que constam as entalpias de ligação, a 25 ºC, das ligações rompidas ou formadas durante a reação em questão. Com base no conjunto de informações apresentado, julgue os itens que se seguem.
A reação de formação da amônia, a partir de H2(g) e N2(g), libera mais calor quando processada a volume constante, comparando-se quando processada a pressão constante.
Disponível em: http://teses.icict.? ocruz.br/pdf/paulajfpm.pdf
Acesso em: 08 out. 2010. (Adaptado)
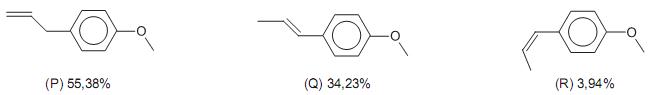
Em relação a algumas reações que podem ser realizadas com o estragol, transanetol e cisanetol, analise as afirmativas a seguir.
I - Os produtos principais da reação de hidrogenação de (P) e (Q), catalisada por platina a 25 °C e a pressão de 1 atm, são isômeros constitucionais.
II - Tanto (Q) como (R) podem descorar uma solução de
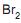 em tetracloreto de carbono com a formação de um mesmo produto principal de reação.
em tetracloreto de carbono com a formação de um mesmo produto principal de reação. III - A reação de (P) com HBr pode levar a formação de um produto de reação idêntico ao obtido na reação de (Q) com HBr.
IV - O calor liberado na reação de hidrogenação da dupla olefínica de (Q) é menor do que na de (R).
Estão corretas APENAS as afirmações
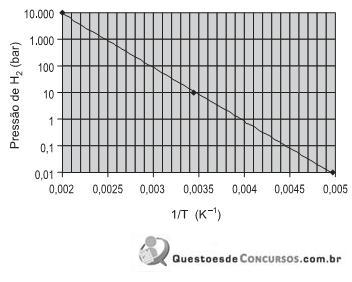
O armazenamento de hidrogênio em volumes reduzidos pode ser conseguido por meio da formação de hidretos metálicos. O gráfico de Van’t Hoff apresentado acima exibe a pressão de equilíbrio de hidrogênio, em função da temperatura para a seguinte reação:
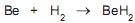
Qual a variação de entalpia, em kJ, estimada para essa reação?
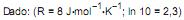
No universo, existem processos espontâneos e não-espontâneos, reversíveis e irreversíveis. O entendimento desses processos é feito pela termodinâmica. Acerca desse assunto, assinale a alternativa correta.
A termodinâmica tem um papel importante em todos os aspectos da vida humana: ela relaciona as propriedades da matéria, como um todo, ao seu comportamento em processos físicos e químicos. A termodinâmica informa se é possível ir de um estado inicial dos reagentes a um estado final dos produtos de uma reação, mas não se importa com o tempo necessário para que essa modificação ocorra. A esse respeito, assinale a alternativa correta.
A termoquímica é o estudo da variação de entalpia das reações químicas quando os reagentes, em seus estados-padrão, são transformados em produtos, também em estados-padrão. Com relação a esse assunto, assinale a alternativa correta.
Para o bom andamento dos experimentos, o técnico deve ter conhecimentos da organização dos reagentes e das vidrarias. Com relação a esse tema, assinale a alternativa correta.
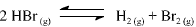
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
Considere as seguintes entalpias padrões, 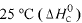
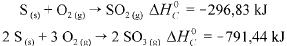
Com base nessas informações, julgue o item que se segue.
A entalpia padrão da reação 2 SO2(g) + O2(g) → 2 SO3(g), a 25
°C ,é igual a -197,78 kJ.
Considere as seguintes entalpias padrões, 
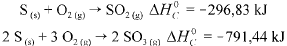
Com base nessas informações, julgue o item que se segue.
O módulo da entalpia padrão de formação do SO3(g), a 25 °C, é m aior que 700 kJ/mol.
