Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
Se uma barra de cobre for colocada dentro de uma solução de H2SO4 em condições padrão, então, considerando-se os potenciais padrão de redução do cobre (Cu2+/Cu, 0,337 V) e do hidrogênio (H+/H2, 0,000 V), a barra de cobre reagirá, e a solução se tornará azul pela presença de Cu2+.
A força eletromotriz é associada à espontaneidade da reação por meio da entalpia.
Em função do potencial de redução de cada semirreação, a força eletromotriz é calculada subtraindo-se o potencial de redução da semirreação de oxidação do potencial de redução da semirreação de redução.
No que se refere às escalas de temperatura, julgue o item subsequente.
A temperatura pode ser determinada por uma escala
padronizada, equivalente ao conceito de energia do
movimento molecular. O zero absoluto é uma temperatura
em que o movimento das moléculas cessa, sendo esse valor,
na escala absoluta, ou escala Kelvin, igual a −273 K. Na
escala Kelvin, a temperatura absoluta é inversamente
proporcional à energia cinética média de translação das
moléculas de um gás.
Com relação à termoquímica, julgue o item que se segue.
A termoquímica é o ramo da química que estuda os calores
de reações e assuntos relacionados. As reações químicas
endotérmicas ocorrem com libertação de calor, ao passo que
as reações exotérmicas ocorrem com absorção de calor. Os
produtos da queima de combustíveis ao ar são muito quentes,
assim, tal reação é fortemente endotérmica, pois a
temperatura dos produtos é mais elevada que a dos
reagentes.
Com relação à termoquímica, julgue o item que se segue.
A combustão é uma reação química em que a substância
simples ou o composto queima na presença de oxigênio,
produzindo-se CO2 e H2O. Nesse sentido, somente
substâncias orgânicas sofrem combustão.
Considere as informações apresentadas no quadro a seguir para responder à questão abaixo :

I. As medidas potenciométricas apresentam alta sensibilidade, tempo de resposta curto, facilidade de escalonamento e automação; elas funcionam bem com solventes orgânicos; cor e turbidez não são interferentes. II. O método potenciométrico se baseia na medida do potencial de células eletroquímicas, com o consumo apreciável de corrente. III. O eletrodo indicador apresenta corrente que varia de forma conhecida com alterações na concentração do analito. IV. O eletrodo de referência é uma meia-célula que tem um potencial de eletrodo conhecido, que permanece constante sob temperatura constante, independente da composição da solução do analito.
Está correto o que se afirma apenas em
Assinale a alternativa que indique corretamente o método descrito acima.
( ) Na oxidação do ferro exposto ao tempo, no anodo ocorre a reação Fe → Fe2+ + 2e − e no catodo ocorre a reação O2 +4H + + 4e − → 2H2O.
( ) Uma forma de proteger a oxidação do ferro e fazer uma proteção catódica, é usar um metal de sacrifício como o magnésio. Isso ocorre pois o ferro possui um potencial de redução mais negativo que o magnésio.
( ) A proteção de superfícies metálicas da corrosão independe do meios corrosivos existentes, sendo o meio corrosivo, um fator secundário da corrosão.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
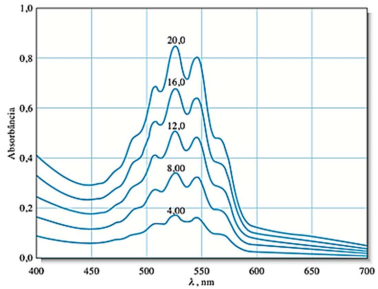
Assinale com V (verdadeiro) ou F (falso) as afirmações a seguir.
( ) Na condição ideal de análise, observa-se que a lei de Beer é aproximadamente obedecida.
( ) Sabendo-se que a solução tem cor violeta, ela absorve majoritariamente radiação de frequência correspondente a essa cor.
( ) Para uma determinação otimizada da concentração de íons permanganato utilizando essa técnica, deve-se utilizar uma radiação de comprimento de onda de 525 nm.
( ) Para uma determinação otimizada da concentração de íons permanganato utilizando essa técnica, deve-se utilizar uma radiação de frequência igual a 525 nm.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
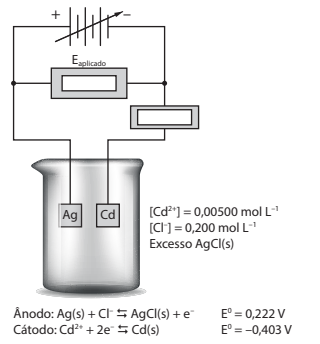
Cd2+ + 2e ⇌ Cd (s) E° = - 0,40 V
Ni2+ + 2e ⇌ Ni (s) E° = - 0,25 V
É correto afirmar
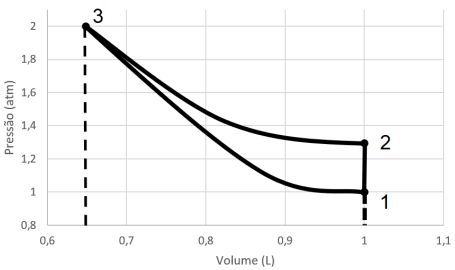
I. A variação de entropia ao longo do ciclo é nula. II. A variação de trabalho ao longo do ciclo é nula. III. A variação de energia interna ao longo do ciclo é nula.
Assinale

Tabela Concentração limite das substâncias que causam interferência na determinação do íon fluoreto.
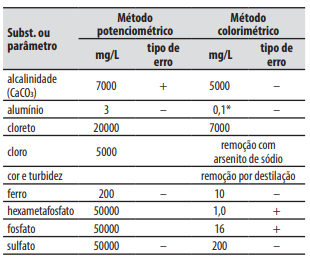
Assinale a alternativa correta a respeito do que foi apresentado.
https://www.inesul.edu.br/site/documentos/ QUIMICA_ANALITICA_SKOOG.pdf
Com relação às espectroscopias no infravermelho e no ultravioleta-visível, julgue o item subsecutivo.
A absorção de radiação no infravermelho é um processo
quantizado.
Com relação às espectroscopias no infravermelho e no ultravioleta-visível, julgue o item subsecutivo.
Os modos de movimento vibracional em uma molécula
ativos no infravermelho são os de estiramento e dobramento,
que dão origem a absorções.
