Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Se não existir matéria como meio de propagação, não é
possível a transferência de calor.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
A capacidade térmica de um corpo consiste na quantidade de
calor que ele necessita ceder ou receber para variar sua
temperatura em 1 grau, sendo diretamente proporcional
à sua massa.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Além dos estados sólido, líquido e gasoso, há o plasma, que
é a condição da matéria associada a partículas muito
energizadas, com certo distanciamento e nenhuma ou pouca
ligação entre si, e cujas propriedades são semelhantes às do
estado líquido, mas com uma energia cinética maior.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
As mudanças de estado de líquido para gasoso podem ser
corretamente chamadas de evaporação, ebulição e calefação,
as quais se diferenciam principalmente pela velocidade em
que ocorrem.
Foi inventada por Alessandro Volta, que publicou seus experimentos em 1799 e é considerado o criador das pilhas elétricas, que desencadeou os diversos avanços no ramo da eletroquímica.
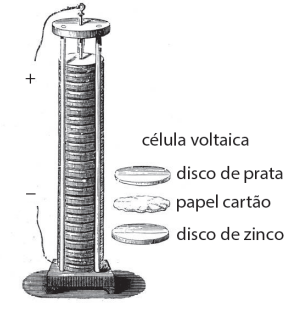
O dispositivo é feito de diversas camadas dos metais zinco e prata, separadas por um disco de material poroso embebido numa solução de sal, conforme representado pela figura ilustrada:
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) a respeito dessa descoberta.
( ) Os discos de zinco constituem o ânodo (oxidação) e os discos de prata constituem o cátodo (redução).
( ) A passagem de elétrons, no circuito externo, é do cátodo para o ânodo.
( ) Os discos de zinco sofrem corrosão com o funcionamento da pilha, cuja semirreação é: Zn(s) ➔ Zn2+ + 2 e– .
( ) O aumento do diâmetro dos discos não influencia a tensão fornecida pela pilha.
( ) Os discos de zinco são fontes de elétrons para o circuito externo.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
A reação de eletrólise é classificada como:
Considere as três reações abaixo:
(1) Ca(s) + ½O2 (g) ⇋ CaO(s)
(2) C12H22O11(s) + 12O2 (g) → 12CO2 (g) + 11H2 O(l)
(3) N2
(g) + 3H2
(g) → 2NH3
(g)
Sobre os valores esperados da variação da
entropia padrão das reações (∆r
S°), podemos dizer que:
Considere a seguinte reação química:
MnO2 + H2O2 + 2HCl ➜ MnCl2 + 2H2O + O2
Analise as afirmativas abaixo com relação a esta reação.
1. Manganês passa de Nox +4 para Nox +2, perde dois elétrons e sofre oxidação.
2. Dióxido de manganês é o agente oxidante.
3. Peróxido de hidrogênio é o agente redutor.
4. Oxigênio passa de Nox –1 para Nox 0, perde um elétron e sofre oxidação.
Assinale a alternativa que indica todas as afirmativas
corretas.
Ag+ (aq) + e- (aq) → Ag(s) E° = 0,80 V Mg2+(aq) + 2e- (aq) → Mg(s) E° = -2,37 V
Determina-se que o potencial padrão da célula em volts, a 25 °C, é
1ª COLUNA (1) potencial elétrico. (2) razão massa/carga. (3) absorção de radiação. (4) emissão de radiação. (5) resistência elétrica.
2ª COLUNA
( ) espectrometria. ( ) condutometria. ( ) espectroscopia. ( ) potenciometria e crono potenciometria. ( ) espectrofotometria e fotometria.
A sequência correta de cima para baixo é:
I - Possível presença de interferentes. II - O tempo necessário para completar a análise. III - A necessidade de se usar um método destrutivo.
É correto o que se afirma em:
“A química eletro analítica compreende um conjunto de métodos _______________e___________________ baseados nas propriedades _________________de uma solução. São capazes de fornecer __________de__________ e um amplo __________________ de informações”.
Cr2O72- + 14 H+ + 6 Fe2+ → 2 Cr3+ + 6 Fe3+ + 7 H2O
50,00mL de amostra, livre de interferentes, foi tratada com 25,00mL de solução de K2Cr2O7 com concentração igual a 0,04167mol.L-1 , além de H2SO4 e Ag2SO4. A titulação do excesso de dicromato na amostra consumiu 12,50mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 . A titulação do branco consumiu 25,00mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 .
Dado: Massa molar de O2 = 32,00 g.mol-1 .
A DQO da amostra, expressa em mgO2 L-1 , é igual a
Alguns eletrodos consistem basicamente em uma pequena câmara, contendo um eletrodo inerte, envolto por um eletrólito, que se comunica com a solução externa (que será medida), por uma membrana polimérica, de vidro ou cristal, que permite a passagem seletiva do íon que será analisado.
Esses eletrodos são chamados de
Note que a absorvância não é uma quantidade medida diretamente, mas é obtida por meio de cálculo matemático a partir dos valores de transmitância.
Assinale a opção que apresenta a relação matemática que define corretamente a absorvância.
Quanto maior o número de partículas na amostra, maior será ______ da radiação incidente e, portanto, menor será a quantidade de radiação incidida no detector.
Assinale a opção que preenche corretamente a lacuna do fragmento acima.
Eletrodos combinados de vidro devem ser armazenados, preferencialmente, em água destilada e na posição vertical, para que o bulbo se mantenha hidratado.