Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
A teoria de Arrhenius para ácidos e bases é baseada da dissociação eletrolítica dos íons hidrogênio e hidroxila em meio aquoso. No entendimento de Arrhenius, as bases são compostos que, quando dissolvidos em água, aumentam a concentração de íons OH-. Essa teoria/definição explica apenas alguns fenômenos básicos (quando dissolvidos em água), porém não explica quando envolvidas substâncias em soluções não aquosas. De acordo com a teoria mais abrangente existente, as bases são compostos que doam um par de elétrons. Qual/is foi/foram o(s) cientista(s) proponente(s) de tal definição?
(BROWN, Theodore L. Química, a ciência central. São Paulo: Prentice Hall, 2005)
O ácido ascórbico (AA) é uma cetolactona, presente em frutas cítricas, tomate e vegetais de folhas verdes. O AA atua em reações de oxirredução em pelo menos 10 sistemas enzimáticos e na captura de radicais livres:
C6H8O6 + 2H+ + 2NO2 ⟶ C6H6O6 + 2H2O + 2NO
Qual dos seguintes pares identifica os agentes redutores e oxidantes, respectivamente?
Julgue o item que se segue.
Em geral, a energia de ionização aumenta da esquerda
para direita na tabela periódica. No caso do átomo de
oxigênio, essa energia é menor do que a do átomo de
nitrogênio. Essa discrepância ocorre devido à repulsão de
um par de elétrons do oxigênio presentes em um dos
orbitais p.
Julgue o item que se segue.
O grafite e o diamante são alótropos do carbono. As
propriedades desses materiais são muito diferentes,
apesar de eles conterem apenas átomos de carbono.
Essas diferenças se devem ao fato de os átomos de
carbono apresentarem as hibridizações do tipo sp² no
diamante, e do tipo sp³ no grafite.
Julgue o item que se segue.
O íon Cr3+ pode ser convertido no íon Cr6+ em meio
aquoso, espécie muito ácida que pode alterar
expressivamente o pH do meio, podendo trazer danos à
vida aquática e aos seres humanos.
( ) A variação de entalpia (ΔH) de um sistema informa a quantidade de calor trocado por esse sistema à pressão constante. O sinal de ΔH informa se o processo é exotérmico ΔH>0 ou endotérmico ΔH<0.
( ) A representação de uma equação termoquímica deve incluir os coeficientes estequiométricos de todos os participantes e o ΔH do processo.
( ) A entalpia padrão de formação (ΔH0f) é positiva para as substâncias simples, desde que estejam no estado-padrão, no estado físico e na variedade alotrópica mais estável.
( ) Os valores ∆H são numericamente iguais, mas de sinais opostos, para reações químicas que sejam o inverso uma da outra.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Se 100 g de uma substância radioativa apresenta tempo de meia‑vida de 2 horas, após 4 horas restará 12,5 g dessa substância.
I2 + KOH → KI + KIO3 + H2O
Analise as afirmações sobre a reação acima:
( ) O iodo é o agente oxidante e redutor.
( ) Após balanceamento da equação, verifica-se que a soma dos coeficientes estequiométricos é igual em ambos os membros da equação.
( ) O iodo é o agente oxidante e o hidróxido de potássio é o agente redutor.
( ) Os nomes oficiais dos compostos de iodo produzidos são iodeto de potássio e periodato de potássio, respectivamente.
Classificando as afirmações em VERDADEIRAS (V) ou FALSAS (F) a ordem CORRETA obtida, de cima para baixo, é:
https://www.ecycle.com.br/bom-ou-ruim-usado-como-conservante-em-vinhos-dioxido-de-enxofrepode-causar-reacoes-alergicas/ (adaptado) acessado:2109/2023.
Ao se atacar 1,04 kg de sulfito de magnésio, com ácido clorídrico, qual o volume de anidrido sulfuroso obtido a 27°C e 1869 mmHg?
XCO3(s) → XO(s) + CO2(g)
Considerando-se a pureza do carbonato e a sua decomposição assumidamente completa, o elemento X em questão é o
Na Tabela a seguir, são apresentados três alcenos isômeros.
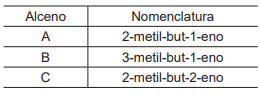
A representação em ordem crescente de energia liberada na combustão de 1 mol do alceno é a seguinte
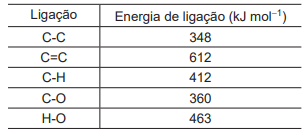
A variação de entalpia, em kJ mol-1 , da reação correspondente a esse processo industrial é
BrO3 - (aq) + 6 H+ (aq) + 6 e- → Br- (aq) + 3 H2 O (l) Eo red = +1,44 V
I2 (s) + 2 e- → 2 I- (aq) Eº red = +0,54 V
Em relação à pilha formada, observa-se que
I - C (s) + H2 O (v) → CO (g) + H2 (g) ∆H° = -28.000 cal mol-1 II - CO (g) + H2 O (v) → CO2 (g) + H2 (g) ∆H° = +9.400 cal mol-1 III - C (s) + 2 H2 O (v) → CO2 (g) + 2 H2 (g)
Considerando-se essas informações, a variação de entalpia, em cal mol-1 , da equação termoquímica III é
A relação entre essas grandezas é expressa por
Em um laboratório, foram realizadas quatro réplicas de uma análise de cromo em uma liga metálica, obtendo-se os seguintes valores: 14 mg g-1 , 10 mg g-1 , 16 mg g-1 e 12 mg g-1 .
Para esse conjunto de dados, o desvio-padrão, em mg g-1 , encontra-se na faixa entre