Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.495 questões
Uma corrente elétrica que percorre um condutor gera, em torno desse condutor, um campo magnético com direção determinada pela regra da mão esquerda.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Supondo que todo o oxigênio produzido na eletrólise seja
lançado na atmosfera, então, a 1 atm de pressão e 298 K de
temperatura, uma tonelada de água submetida à eletrólise
lançará mais de 500.000 L de oxigênio na atmosfera.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Uma tonelada de água produzirá menos de 120 kg de
hidrogênio em uma eletrólise.
Acerca da termoquímica, julgue o item subsequente.
Uma reação reversível que seja exotérmica em um sentido
será endotérmica no sentido oposto; se uma reação química
libera calor, ela é exotérmica; se, durante uma reação
química, calor é absorvido do meio, então a reação em
questão é endotérmica.
Acerca da termoquímica, julgue o item subsequente.
O valor calorífico de um combustível é medido a partir do
calor de absorção que ele apresenta.
Tendo como referência o assunto tratado no texto precedente, julgue o item que se segue.
Os processos de combustão geram energia térmica suficiente
para promover reações secundárias entre o nitrogênio (N2) e
o oxigênio (O2), componentes majoritários do ar atmosférico,
o que leva à produção de dióxido de nitrogênio (NO2), que,
por sua vez, é rapidamente oxidado a monóxido de
nitrogênio (NO).
A estequiometria é aplicada em diversos estudos sobre a composição química de compostos e suas transformações químicas. No que se refere à estequiometria, julgue o item a seguir.
A estequiometria de uma reação apresenta a relação
qualitativa de reagentes formados e de produtos consumidos
nas diversas reações químicas indicadas por uma equação
química.
Na situação proposta, a potência média do calor emitido pelo petróleo durante seu resfriamento será igual a 2,0×105 W.
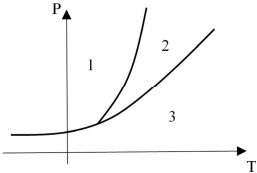
Na figura precedente, que corresponde ao diagrama de
fases de uma substância obtida a partir do fracionamento do
petróleo, as regiões 1, 2 e 3, delimitadas pelas curvas, estão
associadas aos estados físicos da substância, de acordo com as
condições de temperatura (T) e pressão (P).
Com base na figura e nas informações precedentes, julgue o próximo item.
A mudança de fase da substância do estado 1 diretamente
para o estado 3 corresponde ao que se denomina sublimação.
A respeito de transferência de calor, mudanças de estado e calorimetria, julgue o item que se segue.
Considere que a temperatura do petróleo extraído em uma
bacia terrestre seja igual a 110 °C. Nesse caso, se esse
petróleo for bombeado por meio de longas tubulações
metálicas até chegar aos tanques de armazenamento, o
petróleo não trocará calor com o meio externo.
Caso o petróleo extraído de um poço esteja armazenado em um tanque metálico por um tempo longo e suficiente para que esse petróleo esteja em equilíbrio térmico com as paredes do tanque e o meio externo, então, nessa situação, não haverá trocas de energia térmica entre o petróleo e o meio externo.
Julgue o item a seguir, a respeito de dilatação térmica.
Para um material isotrópico, o coeficiente de dilatação
volumétrico (y) se relaciona com o coeficiente de dilatação
linear (a) por meio da equação 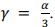
Uma estratégia que permite retirar as tampas metálicas de conservas de vidro é o resfriamento da tampa, se o coeficiente de dilatação linear da tampa metálica for superior ao do vidro.
Julgue o seguinte item, em relação à eletroquímica.
O potencial da semirreação representada a seguir não depende do pH.
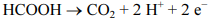
Julgue o seguinte item, em relação à eletroquímica.
Os potenciais-padrão das semirreações de oxirredução são
medidos com base no eletrodo-padrão de hidrogênio, cujo
valor estabelecido é 0,00 V.
Julgue o seguinte item, em relação à eletroquímica.
Considerando-se os potenciais de redução 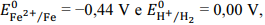 é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
Segundo a IUPAC, a dupla barra vertical na notação das pilhas eletroquímicas representa a ponte salina.
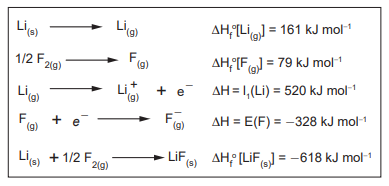
Nesse contexto, o valor aproximado da entalpia de rede (ΔHrede) para o LiF(s), em kJ mol-1 , é
Dado F = 96.500 C mol-1