Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
(Duberney Hincapie-Ladino; Neusa Alonso Falleiros. Trincamento induzido por hidrogênio em aços microligados. Tecnol. Metal. Mater. Miner., São Paulo, v. 12, n. 1, p.82-93, jan./mar. 2015)
Assim sendo, assinale com V a(s) afirmativa(s) considerada (s) verdadeiras e com F a(s) falsa(s).
( ) O fenômeno da fragilização por hidrogênio é definido como a diminuição da ductilidade pela entrada de hidrogênio atômico no metal; aços com alta resistência são muito vulneráveis, como os aços temperados e revenidos ou endurecidos por precipitação.
( ) Certos elementos e compostos químicos aceleram a entrada de hidrogênio aumentando os danos. Entre as espécies presentes no eletrólito, que promovem a entrada de hidrogênio no metal, estão os compostos dos elementos fósforo, arsênio e antimônio pertencentes ao grupo 5A, somente.
( ) A fratura induzida pelo hidrogênio normalmente é reportada em aços microligados, expostos a ambientes ácidos (sour gas), encontrados na indústria do petróleo e gás.
( ) O trincamento induzido por hidrogênio se inicia com a corrosão do aço no meio aquoso (sour gas) onde são gerados átomos de hidrogênio (H) na superfície do aço.
As afirmativas são, respectivamente,
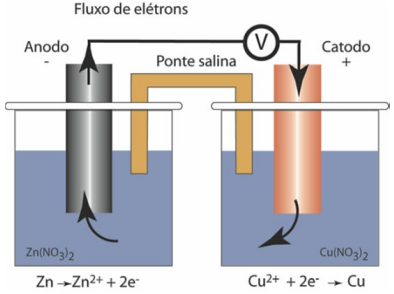
Como mostra a figura, a formação desse tipo de pilha é apenas uma das maneiras através da qual pode ser desencadeada a corrosão eletrolítica. A pilha de corrosão evidenciada acima ocorre devido à diferença de potencial de eletrodo entre os diferentes metais, e é mais reativa quanto maior for esta diferença de potencial. Esse tipo de pilha compreende um exemplo clássico das pilhas de corrosão eletroquímicas, que é conhecido por
As bactérias redutoras de sulfato (BRS) têm grande importância na biocorrosão. Embora, até o momento não exista a determinação de um mecanismo único de corrosão ocasionado pela ação das BRS, Kuhr e Vlug (1934) propuseram um mecanismo no qual essas bactérias utilizam o hidrogênio proveniente do consumo realizado pela hidrogenase, catalisando a ativação reversível de hidrogênio. Em condições anaeróbicas, essa reação de corrosão é a evolução de hidrogênio pela dissociação da água, em que os íons de hidrogênio produzidos se encontram adsorvidos sobre a superfície metálica, sendo posteriormente consumidos pelo processo metabólico, como mostra a figura abaixo:
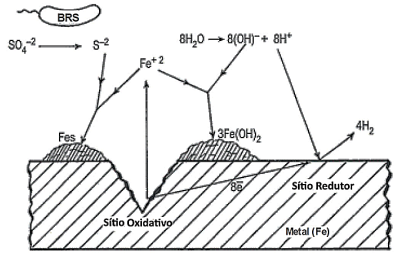
De acordo com o que mostra a figura e a descrição do mecanismo de corrosão supracitado, esse tipo de biocorrosão é classificado como
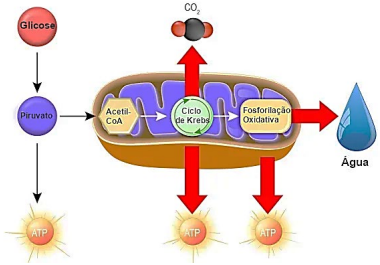
Considerando o que mostra a figura e todos os demais fenômenos metabólicos que ocorrem na respiração celular e nas suas etapas, assinale a alternativa correta.
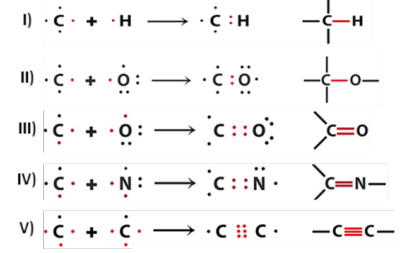
Dentre essas ligações que o carbono é capaz de fazer com ele mesmo ou com outros tipos de átomos, aquela que é mais rara de ocorrer nas biomoléculas é
As duas primeiras formas caracterizam
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Potencial de eletrodo é a medida do potencial individual de
um eletrodo reversível no estado-padrão, ou seja, solutos em
concentração de 1 mol/kg e gases à pressão de 1 bar, ambos
a 273 K.
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Para determinar a capacidade de um metal em atuar como anodo de sacrifício, é adequado montar um eletrodo com o referido metal, com potencial desconhecido, ligá-lo a um eletrodo de potencial conhecido e medir a diferença de potencial entre os eletrodos. Nesse contexto, pode-se usar, para a avaliação, um eletrodo de zinco metálico (Zn), que, em uma célula eletroquímica com solução 1 mol/L de ZnSO4, apresenta a seguinte semirreação no anodo.
Zn (s) → Zn2+ (aq) + 2 e−
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
A equação de Nernst tem por finalidade prever o potencial
de uma pilha durante o seu funcionamento, correlacionando
a variação do potencial da pilha em certo instante da reação
com a variação das concentrações de produtos e reagentes.