Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
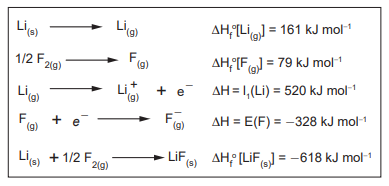
Nesse contexto, o valor aproximado da entalpia de rede (ΔHrede) para o LiF(s), em kJ mol-1 , é
Dado F = 96.500 C mol-1
8Al (s) + 3Fe3 O4(s) = 9Fe(s) + 4Al 2 O3(s) + CALOR
Considere 100,0 g de alumínio de soldagem com pureza de 81% e que a reação tem 75% de rendimento, por causa da troca de calor com o ambiente.
A quantidade de ferro, em gramas, formada nesse processo é, aproximadamente, de
Na determinação potenciométrica de K+, utilizou-se um sistema composto por um eletrodo seletivo de membrana com vanilomicina e um eletrodo de referência de Ag|AgCl(LiCl(sat)).
Nesse sistema, o sinal que é relacionado com a concentração de analito é da(o)

Internet:<www.tabelaperiodica.org>
Acerca da espectroscopia de absorção molecular no ultravioleta e no visível, julgue o item.
O termo “deslocamento hipsocrômico” é usado para
descrever a mudança da banda de absorção para
regiões do espectro onde o comprimento de onda
é maior

Internet:<www.tabelaperiodica.org>
Acerca da espectroscopia de absorção molecular no ultravioleta e no visível, julgue o item.
O termo “deslocamento batocrômico” é utilizado
para descrever a mudança da banda de absorção para
regiões do espectro onde a energia é menor.

Internet:<www.tabelaperiodica.org>
Acerca da espectroscopia de absorção molecular no ultravioleta e no visível, julgue o item.
À medida que o número de moléculas capazes de absorver luz de um determinado comprimento de onda aumenta, a extensão dessa absorção diminui, de acordo com a Lei de Lambert‑Beer expressa pela equação a seguir.
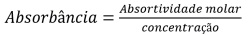

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
A entalpia não é uma função de estado, o que significa
que sua variação depende do caminho percorrido, e
não apenas dos estados inicial e final.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
Em uma reação química conduzida à pressão
constante, se o sistema liberar 45 kJ.mol‑1 de calor (Q)
e realizar 20 kJ.mol‑1 de trabalho de expansão (W), a
variação da entalpia será de ‑45 kJ.mol‑1.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
Em uma reação química realizada à pressão constante,
quando o sistema libera 60 kJ.mol‑1 de energia na
forma de calor (Q) e realiza 10 kJ.mol‑1 de trabalho
de expansão (W), a variação da energia interna é
de ‑70 kJ.mol‑1.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
A primeira lei da termodinâmica afirma que a energia
total em um sistema isolado é constante, podendo
apenas ser transformada de uma forma para outra.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
Toda transformação isocórica ocorre com pressão
constante.
Julgue o próximo item, acerca da caracterização de nanomateriais.
As técnicas comumente usadas para a caracterização óptica
de nanomateriais são a espectroscopia na região do
infravermelho com a transformada de Fourier e a
espectroscopia de fotoelétrons induzidos por raios X.
No que se refere à modificação de superfícies, julgue o seguinte item.
A funcionalização de superfícies antimicrobianas é uma
tecnologia que pode ser utilizada para desinfecção em vários
ramos da atividade humana, por exemplo, na esterilização de
dispositivos médicos para prevenir infecções hospitalares.
4Fe(s) + 3O2(g) + 2H2O(l) → 2Fe2O3.H2O(s)
Uma das maneiras de evitar esse fenômeno é
Assinale a alternativa que cujas palavras ou expressões completam corretamente as lacunas da frase.
A Lei de Faraday da eletrólise enuncia que “a quantidade do produto formado ou do reagente consumido por uma corrente elétrica é estequiometricamente equivalente à quantidade de elétrons fornecidos”. Pode-se afirmar, portanto, que a quantidade (em mols) de Al(s) que pode ser produzida a partir do alumínio no composto Al2O3, se 5 mols de elétrons forem fornecidos, é aproximadamente:
(ATKINS; JONES, Princípios de Química: questionando a vida moderna e o meio ambiente, Editora Bookman, 2006)
“A energia livre de Gibbs é uma grandeza termodinâmica notável”. A entropia é considerada uma função de estado assim como a entalpia. Considerando a síntese da amônia a partir de N2(g) e H2(g) a 298 K conforme equação a seguir:
(BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005, p. 702)
N2(g) + 3 H2(g) → 2 NH3(g)
E conhecendo as informações do quadro abaixo:
Substância |
ΔHºf(kJ.mol-1) |
Sº (J.mol-1.k-1) |
N2(g) |
0 |
191,5 |
H2(g) |
0 |
130,6 |
NH3(g) |
–80,3 |
111,3 |
Podemos afirmar, com base nos dados apresentados, que o valor da variação da energia livre de Gibbs para a síntese da amônia, em kJ.mol-1, é aproximadamente: