Questões de Concurso Público IF-SE 2024 para Professor EBTT - Química
Foram encontradas 30 questões
Dados: pH = -log [H3O+] Constante de autoionização da água, Kw = 1,0 x 10-14
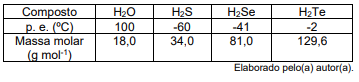
A justificativa que responde a variação do ponto de ebulição para os calcogenetos de hidrogênio é que a substância
Observe a equação química não balanceada apresentada a seguir.
m H2S + n HNO3 → o H2SO4 + p NO + q H2O
Elaborado pelo(a) autor(a).
A partir do balanceamento estequiométrico dessa equação,
empregando-se algarismos inteiros, a soma dos
coeficientes m, n, o, p e q é igual a
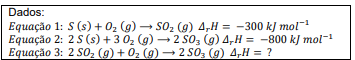
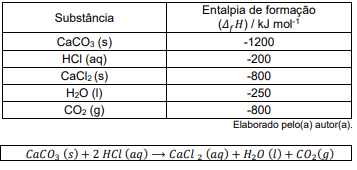
Dadas as entalpias de formação das substâncias listadas na tabela e considerando a equação acima, qual o valor da entalpia de reação para a reação, em kJ mol-1?
Dados: potenciais padrão de redução das semirreações:
Zn2+ (aq) + 2 e− ⟶ Zn (s) E0 = −0,76 V Bi3+ (aq) + 3 e− ⟶ B (s) E0 = +0,20 V
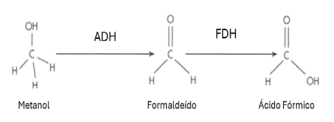
Disponível em: <https://www.anaesthesiamcq.com/AcidBaseBook/ab8_6a.php>. Acesso em: 21 jun. 2024. [Adaptado].
Qual é o número de oxidação do carbono no metanol e no ácido fórmico, respectivamente?
Dados: Constante de Faraday F = 9,5 x 104 C mol-1 Massas molares: Ca: 40 g mol-1; Cl: 35 g mol-1