Questões de Concurso
Foram encontradas 193 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere, em um sistema ideal, que uma chaminé recebeu 2,4 x 1019 moléculas de SO2 que foram misturadas com 10 g do carbonato de cálcio. Nessas condições, quantos miligramas, aproximadamente, de sulfato de cálcio ficariam retidos na chaminé?
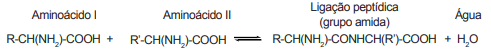 Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?2H2 (g) + 2NO (g) → N2(g) + 2H2O (g)
Para compreender a velocidade da reação química em função das concentrações dos reagentes, um técnico realizou os seguintes experimentos.
Experimento 1 – Quando dobrou a concentração do gás hidrogênio e reduziu à metade a concentração do óxido nítrico, a velocidade da reação dobrou.
Experimento 2 – Quando quadruplicou a concentração do gás hidrogênio e dobrou a concentração do óxido nítrico, a velocidade da reação química quadruplicou.
A partir dessas informações, é correto afirmar que a expressão matemática da Lei de Velocidade é representada por:
Sendo assim, os reatores
Se a decomposição desse composto ocorre a 27°C, o valor aproximado da constante de velocidade, em s-1, é
Dados R = 8,31 J/mol.K ln (5x10-4 ) = -7,6
