Questões de Concurso
Para uece-cev
Foram encontradas 5.706 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Mesmo que um modelo atômico consiga explicar muitos fenômenos ele não explica tudo o que acontece, e pode ser substituído. Em se tratando de modelos atômicos analise as proposições abaixo:
I. O modelo de Dalton foi um resgate da primitiva teoria atômica de Epicuro que viveu entre 341 a.C. e 270 a.C.
II. Rutherford postulou que o átomo era uma esfera maciça de carga positiva com cargas negativas incrustadas na superfície.
III. O modelo de Bohr repousava na mecânica clássica e explicava perfeitamente a existência de órbitas estacionárias.
IV. O modelo atual foi concebido com as contribuições de De Broglie, Heisenberg e Schrödinger.
V. O número quântico spin foi introduzido por Wolfgang Pauli para explicar a descoberta da duplicação das raias espectrais.
Está correto o que se afirma somente em
Uma peça importante no processo de aprendizagem é o livro didático. Sua seleção deve ser criteriosamente realizada. Atente para as seguintes afirmações a respeito dos parâmetros significativos dessa seleção:
I. O livro didático deve mostrar caminhos metodológicos comprovadamente eficazes;
II. deve apresentar exercícios repetitivos ou de memorização;
III. deve ser coerente do ponto de vista teórico com os conteúdos apresentados.
É correto o que se diz em
Atente para a seguinte reação reversível em equilíbrio:
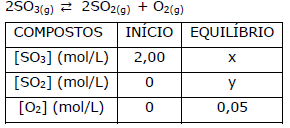
Considerando o quadro acima, é correto afirmar que o
valor de Kc para a reação é
A molécula da anandamida é capaz de aliviar a ansiedade e induzir a uma situação de tranquilidade e relaxamento. O chocolate é uma das fontes dessa substância.
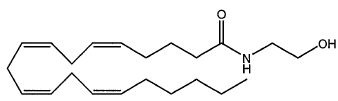
A fórmula molecular desse composto é a seguinte:
Atente para o que se afirma a seguir sobre as propriedades periódicas dos elementos químicos:
I. Considerando o segundo período da tabela periódica, é correto afirmar que quanto maior a atração entre núcleo e eletrosfera, menor é o raio atômico.
II. Energia de ionização é igual à energia mínima necessária para “arrancar” um elétron de um átomo isolado em estado gasoso.
III. Em um mesmo período da tabela periódica, como os raios diminuem à medida que se aproximam dos gases nobres, a energia de ionização tende a diminuir nesse mesmo sentido.
IV. Conforme nos deslocamos para baixo da tabela periódica, o raio atômico cresce num mesmo grupo. Os elétrons de valência ficam menos atraídos e a energia de ionização cai.
É correto o que se afirma em
O monóxido de nitrogênio, quando liberados pelos automóveis na baixa atmosfera, rapidamente se transforma em dióxido de nitrogênio, que em seguida, irá colaborar na formação do ozônio troposférico, um poluente. Um estudo dessa reação no laboratório revelou que, para que ela se tornasse quatro vezes mais rápida, poderia ser feita a seguinte alteração: manter fixa a concentração de O2 e duplicar a de NO.
Considerando o enunciado acima, atente para as seguintes afirmações:
I. A lei da velocidade dessa reação pode ser dada por: v = k[NO]2 [O2].
II. Essa deve ser uma reação elementar, ou seja,
realizada em apenas uma etapa.
Sobre essas afirmações, é correto diz que
Preencha as lacunas do seguinte quadro,
supondo que cada coluna representa um átomo
neutro:
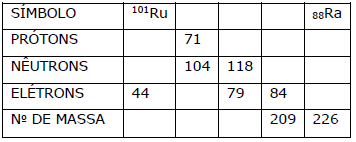
Considerando o quadro acima, assinale a afirmação
FALSA.
Considerando os ácidos listados a seguir, relacione-os corretamente com suas respectivas aplicações, numerando a Coluna II de acordo com a Coluna I.
Coluna I
1. Ácido nítrico
2. Ácido sulfúrico
3. Ácido fluorídrico
4. Ácido fosfórico
Coluna II
( ) usado para gravar sobre vidro
( ) usado como acidulante em refrigerantes
( ) usado na produção de explosivos
( ) usado em solução de bateria
A sequência correta, de cima para baixo, é