Questões de Concurso
Para inb
Foram encontradas 1.557 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
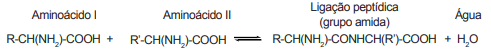 Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?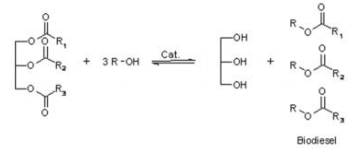 Sobre o processo químico de transesterificação, considere as afirmativas a seguir.
I. A reação de transesterificação do óleo é uma reação de um lipídeo com álcool para formar éster e um subproduto,
a glicerina.
II. Na produção do biodiesel, um dos processos mais usados é a catálise homogênea, em que o catalisador é um
ácido que melhora o rendimento da reação.
III. O álcool mais utilizado no processo de produção do biodiesel é um de cadeia longa que irá favorecer a solubilidade
da gordura na produção do biodiesel.
Estão corretas as afirmativas:
Sobre o processo químico de transesterificação, considere as afirmativas a seguir.
I. A reação de transesterificação do óleo é uma reação de um lipídeo com álcool para formar éster e um subproduto,
a glicerina.
II. Na produção do biodiesel, um dos processos mais usados é a catálise homogênea, em que o catalisador é um
ácido que melhora o rendimento da reação.
III. O álcool mais utilizado no processo de produção do biodiesel é um de cadeia longa que irá favorecer a solubilidade
da gordura na produção do biodiesel.
Estão corretas as afirmativas:PORQUE
II. toda forma de energia precisa de um combustível, e quanto mais energético mais rejeito vai gerar. A respeito dessas asserções, assinale a alternativa CORRETA.
COOH – CHOH – CH2 – COOH → CH3 – CH2 – OH + 2CO2
Em relação ao processo de fermentação do ácido málico, analise as afirmativas a seguir. I. A fermentação ocorre com a diminuição do pH. II. A fermentação ocorre com oxidação do carbono carbonílico. III. Pela ação das bactérias láticas, ocorre a transformação do ácido málico em ácido lático. Estão corretas as afirmativas:
2H2 (g) + 2NO (g) → N2(g) + 2H2O (g)
Para compreender a velocidade da reação química em função das concentrações dos reagentes, um técnico realizou os seguintes experimentos.
Experimento 1 – Quando dobrou a concentração do gás hidrogênio e reduziu à metade a concentração do óxido nítrico, a velocidade da reação dobrou.
Experimento 2 – Quando quadruplicou a concentração do gás hidrogênio e dobrou a concentração do óxido nítrico, a velocidade da reação química quadruplicou.
A partir dessas informações, é correto afirmar que a expressão matemática da Lei de Velocidade é representada por:
COLUNA I 1. Processos mecânicos 2. Processos físicos 3. Processos biotecnológicos 4. Processos químicos
COLUNA II ( ) Utiliza fungos ou bactérias que produzem enzimas capazes de quebrar as cadeias poliméricas da lignina. ( ) É um processo caro, pois a biomassa passa por processo de moagem, em que há um grande consumo de energia. ( ) Método mais comum para esse processo é o cozimento com hidróxido de sódio e sulfeto de sódio. ( ) O material é aquecido pela passagem de vapor d’água, sofrendo hidrólise.
Assinale a sequência CORRETA.
C6 H12O6 (s) + 6O2 (g) → 6CO2 (g) + 6H2O (g)
Nessas condições, e considerando que os gases são ideais, é correto afirmar que a variação de entalpia da mesma reação é, em quilojoules, aproximadamente igual a:
Dado: Constante dos gases (R) = 8,31 JK–1mol–1
Análises químicas mostraram que um lote de carvão específico contém 2% de enxofre em massa. Quando esse carvão é queimado, o enxofre é convertido em gás dióxido de enxofre.
Considerando que nesse processo todo o dióxido de enxofre produzido da queima do carvão reagiu completamente com óxido de cálcio produzindo 2 mil toneladas de sulfito de cálcio, é correto afirmar que a massa aproximada, em toneladas, de carvão queimado é:
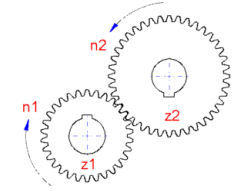 Considerando um engrenamento típico, como
apresentado nessa figura, assinale a alternativa
INCORRETA.
Considerando um engrenamento típico, como
apresentado nessa figura, assinale a alternativa
INCORRETA.