Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Das raízes da mandioca brava é obtido o caldo amarelado conhecido como tucupi. Em uma análise
química do tucupi, além de carbono, hidrogênio, nitrogênio e oxigênio (elementos presentes em
compostos orgânicos), foram encontrados também Ca, Cu, Fe, K, Mg, Mn, Na e Zn. Com base nesse
conjunto de informações, responda a questão.
Considerando as substâncias formadas pela ligação química de um átomo de carbono com i) 4 átomos de hidrogênio, ii) dois átomos de oxigênio e iii) um átomo de oxigênio e dois de hidrogênio, tem-se as afirmativas:
I- Uma das moléculas formadas apresenta geometria trigonal plana.
II- Uma delas possui ângulo de ligação igual a 104,5 °.
III- Todos são moléculas polares.
IV- Entre as forças intermoleculares presentes, não há, em nenhum caso, ligação de hidrogênio.
V- O composto formado por carbono e oxigênio deve apresentar o menor ponto de fusão entre os três.
Está correto o que se afirma em
Das raízes da mandioca brava é obtido o caldo amarelado conhecido como tucupi. Em uma análise
química do tucupi, além de carbono, hidrogênio, nitrogênio e oxigênio (elementos presentes em
compostos orgânicos), foram encontrados também Ca, Cu, Fe, K, Mg, Mn, Na e Zn. Com base nesse
conjunto de informações, responda a questão.
I- Devido à eletronegatividade de seus elementos, possui geometria angular. II- Sua base conjugada é o íon carboneto. III- Trata-se de um composto covalente. IV- Seu átomo de carbono tem hibridação sp3 . V- Possui ligação carbono-nitrogênio mais curta que aquela presente na metilamina.
Está correto o que se afirma em
Considerando:
I) Os dados da questão anterior, II) Que o decaimento radioativo é um processo cinético de primeira ordem que atende à equação: ln N – ln N0 = λ. t III) ln 2 = 0,693.
A constante de decaimento, em ano-1 , para o césio 137 nesse caso seria igual a:
Considerando I) os dados da questão anterior, II) que o decaimento radioativo é um processo cinético de primeira ordem que atende à equação ln N – ln N0 = λ. t e III) que ln 2 = 0,693,
a constante de decaimento, em ano-1 , para o césio 137, nesse caso, seria igual a
Obs.: Massas molares em g.mol-1 : Na = 23 e Cl = 35,5.
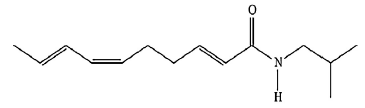
Sobre esta substância, faz-se as seguintes afirmativas:
I- possui a função amina, II- apresenta 7 carbonos com hibridação sp2 , III-possui 23 átomos de hidrogênio, IV- pode apresentar isomeria óptica, V- apresenta a função amida.
Estão corretos os itens
Dados: calor específico da água (c) = 4,18 J/goC.
I. Em uma reação endotérmica, a entalpia do sistema reativo cresce, ou seja, a entalpia dos produtos é maior do que a entalpia dos reagentes. II. A lei da conservação de energia estabelece que a energia não é criada nem destruída em uma mudança de estado físico. III. A variação de entalpia da reação depende do caminho que as reações ocorrem – Lei de Hess.
Está(Estão) correta(s) a(s) afirmativa(s)
I. A primeira energia de ionização, I1, é a quantidade de energia necessária para remover o elétron mais fracamente ligado de um átomo gasoso. II. A afinidade eletrônica é a alteração de energia quando um átomo gasoso ganha um elétron para formar um íon gasoso. III. É modo geral, ao longo de um período, a carga nuclear efetiva Zef aumenta e, consequentemente, fica mais difícil remover um elétron.
Está(Estão) correta(s) a(s) afirmativa(s)
A configuração eletrônica do átomo de ferro Fe e seu íon Fe (III) são, respectivamente,
Dado: número atômico do Fe= 26