Questões de Vestibular
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 151 questões
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
(http://exame.abril.com.br. Adaptado.)
Para a produção de chuva artificial, um avião adaptado pulveriza gotículas de água no interior das nuvens. As gotículas pulverizadas servem de pontos de nucleação do vapor de água contido nas nuvens, aumentando seu volume e massa, até formarem gotas maiores que, em condições meteorológicas favoráveis, podem se precipitar sob a forma de chuva.
Segundo dados da empresa ModClima, dependendo das condições meteorológicas, com 1 L de água lançada em determinada nuvem é possível produzir o volume equivalente a 50 caminhões-pipa de água precipitada na forma de chuva. Sabendo que um caminhão-pipa tem capacidade de 10 m3 , a quantidade de chuva formada a partir de 300 L de água lançada e a força intermolecular envolvida na formação das gotas de chuva são, respectivamente,
Dados de massas molares em g mol-1 : C=12; N=14 e O=16.
Dados: Equação da reação: ½ N2 + O2 → NO2
Massas molares em g mol-1: N2=28 , O2=32 e NO2= 46
CaF2 (s) + H2SO4 (l) → CaSO4 (s) + 2 HF (g)
Considere que a massa molar do HF seja igual a 20 g· mol-1 e que a massa molar do CaF2 seja igual a 78 g· mol-1. Se 100 kg de ácido fluorídrico são obtidos a partir de 260 kg de fluorita impura, é correto afirmar que o teor percentual, em massa, de CaF2 nesse minério é
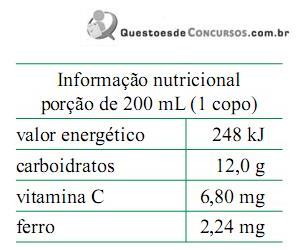
Dada a constante de Avogadro, 6,0 × 1023 mol-1, é correto afirmar que 1 litro desse suco contém um número total de espécies de ferro, massa molar 56 g· mol-1, igual a
Se a massa de CO2 produzida foi 13,9 g, a quantidade em mol de CO é:
B2O3 + 3Mg → 2B + 3MgO
Partindo-se de 262,5 g do óxido de boro em excesso de magnésio, obteve- se 33 g de B, o que significa que o rendimento percentual (%) da reação foi mais próximo de:

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.
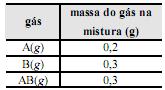
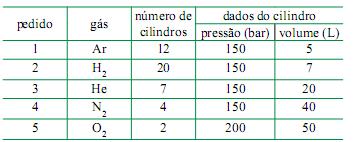
Sabendo que os cilindros rígidos e fechados estão armazenados na mesma condição de temperatura, o pedido que tem maior quantidade de matéria, em mol de gás, é o de número
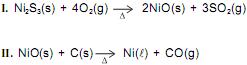
Um dos processos de obtenção do níquel, metal utilizado na fabricação de moedas, consiste, inicialmente, no aquecimento de sulfeto de níquel(III) na presença de ar. Durante esse processo, são formados óxido de níquel(II) e de dióxido de enxofre, de acordo com a equação química I, e, posteriormente, o NiO(s) reage com o carvão, em forno siderúrgico, com obtenção do níquel metálico e do monóxido de carbono, conforme reação representada na equação química II.
Considerando-se as informações do texto e as equações químicas I e II que representam, resumidamente, esse processo, é correto afirmar:
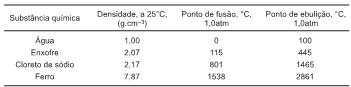
As substâncias químicas têm propriedades bem definidas e, eventualmente, duas substâncias diferentes podem possuir algumas propriedades iguais, mas não todas elas.
Considerando-se essas informações e os dados da tabela que representa algumas propriedades de substâncias químicas, é correto afirmar:
Considere que a análise das cinzas geradas pela queima da casca do fruto de macaúba tenha evidenciado a presença de 0,040 g de óxido de sódio e 0,044 g de óxido de magnésio. Nesse caso, a massa de sódio presente na casca analisada é superior à massa de magnésio.


