Questões de Vestibular
Sobre isomeria: isomeria espacial: isomeria geométrica (cis-trans) e isomeria óptica. em química
Foram encontradas 206 questões
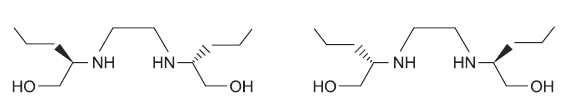
O Transtorno de Déficit de Atenção e Hiperatividade (TDAH) é uma doença crônica, comum no mundo inteiro. Entre seus sintomas, é comum observar inquietação, irritabilidade, dificuldade de concentração, ansiedade e depressão. O tratamento consiste em psicoterapia e medicamentos. O Adderall, cujo princípio ativo é composto por dois isômeros, cujas estruturas (1 e 2) estão representadas abaixo.

Com base nas estruturas (1) e (2), assinale a
alternativa correta:
Adaptado de: Ensaio sobre a identidade cultural cearense a partir do baião de dois, revista Essentia, universidade estadual vale do acaraú, disponível em: http://www.uvanet.br/essentia/index.php/revistaessenti a/article/view/113/122 acesso em: <15/05/2019> Pinto, Jennifer vieira. PROPRIEDADES FÍSICAS, QUÍMICAS, NUTRICIONAIS E TECNOLÓGICAS DE FEIJÕES (Phaseolus vulgaris L.) DE DIFERENTES GRUPOS DE COR. Dissertação(mestrado)-universidade federal de Goiás, 2016. Disponível em: acessado em 15/05/2019
Figura 01 Figura 02
Assinale a alternativa que apresenta proposição correta:
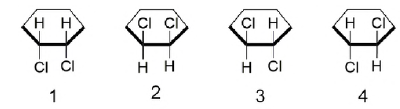
Considere as estruturas representadas em projeção de Fischer.
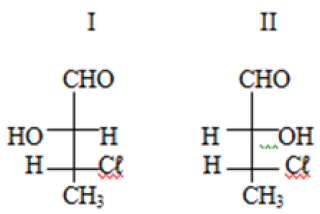
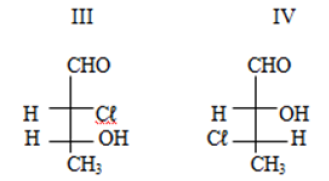
As estruturas que representam um par de enantiômeros são as indicadas pelos números:

Assinale a opção que apresenta a estrutura do isômero do hexanal.
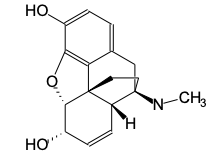
Analisando a estrutura da morfina, constata-se que o número de carbonos quirais presentes é igual a
O estudante propôs uma estrutura a mais porque considerou em sua resposta que:
Etambutol
Considerando-se a introdução do novo fármaco antibiótico, e de acordo com os conhecimentos de Química, é correto afirmar:
Em uma das etapas do ciclo de Krebs, ocorre uma reação química na qual o íon succinato é consumido. Observe a fórmula estrutural desse íon:
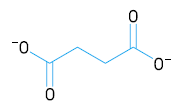
Na reação de consumo, o succinato perde dois átomos de hidrogênio, formando o íon fumarato.
Sabendo que o íon fumarato é um isômero geométrico trans, sua fórmula estrutural corresponde a:
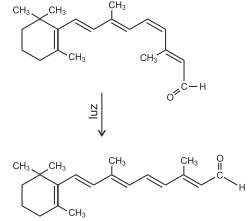
O processo de visão é iniciado na retina a partir de células fotorreceptoras que utilizam pigmentos contendo proteínas e o cis-retinal, um derivado da vitamina A, fotorreceptor. Durante o processo, o cis-retinal absorve luz e se transforma em trans-retinal, representados na equação química, gerando um impulso elétrico, que é enviado ao cérebro. O trans-retinal é reconvertido à forma cis, que absorve luz e dá continuidade ao processo.
A análise dessas informações permite concluir:
Em uma das etapas do ciclo de Krebs, ocorre uma reação química na qual o íon succinato é consumido. Observe a fórmula estrutural desse íon:
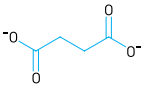
Na reação de consumo, o succinato perde dois átomos de hidrogênio, formando o íon fumarato.
Sabendo que o íon fumarato é um isômero geométrico trans, sua fórmula estrutural
corresponde a:
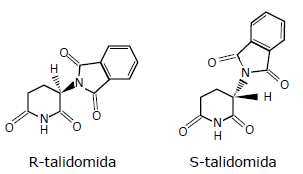
Estrutura R = medicamento sedativo e hipnótico; Estrutura S = medicamento causador da anomalia.
Com relação a esses dois isômeros, é correto afirmar que
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
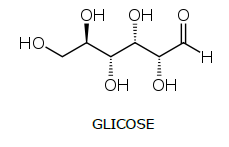
Na estrutura da glicose, é possível observar a geração de isômeros ópticos que se apresentam em um total de
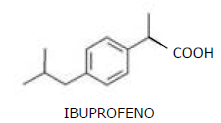
Com relação à estrutura do ibuprofeno, assinale a afirmação correta.
DADOS QUE PODEM SER USADOS NESTA PROVA:

A glicose é uma das principais fontes de energia para o ser humano, sendo também conhecida como “açúcar do sangue”. Atente à estrutura da glicose:
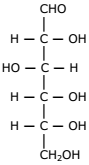
No que diz respeito à isomeria óptica que ocorre
com a estrutura da glicose, assinale a afirmação
verdadeira.
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
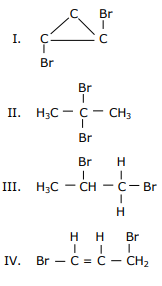
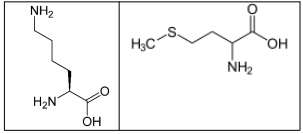
No que diz respeito às moléculas apresentadas, assinale a afirmação verdadeira.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
As duas proposições abaixo estão relacionadas com a preparação e separação de compostos opticamente ativos:
( ) os organismos vegetais e animais produzem seus compostos opticamente ativos já na forma (dextrógira ou levógira) adequada a seu metabolismo. No laboratório, porém, as reações comuns produzem misturas racêmicas.
( ) a separação de uma mistura racêmica não é fácil em virtude de dois enantiomorfos terem propriedades físicas iguais.
Marcando com V a afirmativa verdadeira e
com F a falsa, assinale a seqüência correta de
cima para baixo.
Considerando-se a fórmula molecular C4H8, pode-se afirmar que o número de isômeros possíveis para ela é:
