Questões de Vestibular de Química
Foram encontradas 1.430 questões
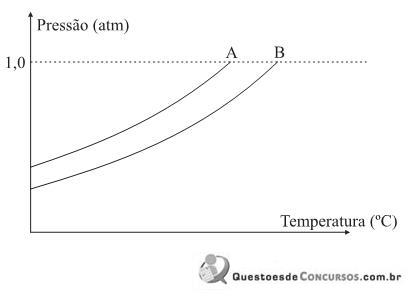
Considerando-se o comportamento da pressão de vapor em relação à temperatura de um terceiro líquido, C, uma solução aquosa de nitrato de alumínio,
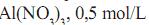 e das cur- vas A e B, são feitas as seguintes afirmações:
e das cur- vas A e B, são feitas as seguintes afirmações:I. A curva da solução C deve se posicionar à esquerda da curva A.
II. A temperatura de ebulição do líquido A é menor que a temperatura de ebulição do líquido B.
III. A solução C dever apresentar maior pressão de vapor que o líquido B.
IV. O líquido A é água destilada.
É correto apenas o que se afirma em

A partir desses resultados, pode-se classificar os compostos X, Y e Z, respectivamente, como sólidos
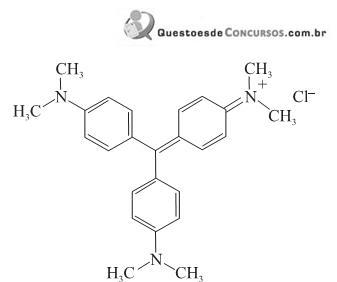
Em relação à violeta genciana, afirma- se:
I. Apresenta grupos funcionais amina e radicais metila
II. Apresenta carbono quiral.
III. Forma ligação de hidrogênio intermolecular.
É correto apenas o que se afirma em
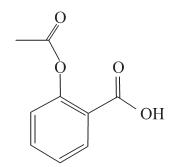
Na hidrólise da aspirina é formada uma substância que está presente no vinagre e também o ácido salicílico, que tem fórmula molecular
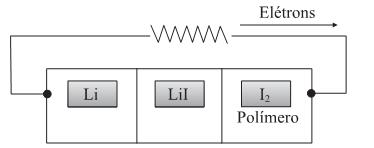
Para esta pilha, são dadas as semi-reações de redução:

São feitas as seguintes afirmações sobre esta pilha:
I. No ânodo ocorre a redução do íon Li + .
II. A ddp da pilha é + 2,51 V.
III. O cátodo é o polímero/iodo.
IV. O agente oxidante é o
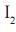 .
.São corretas as afirmações contidas apenas em
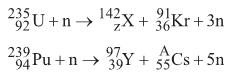
Nas equações, Z, X, A e o tipo de reação nuclear são, respectivamente,


Essa frase fica correta quando as lacunas I, II e III são preenchidas, respectivamente, por:
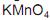 em meio de ácido sulfúrico a quente.
em meio de ácido sulfúrico a quente.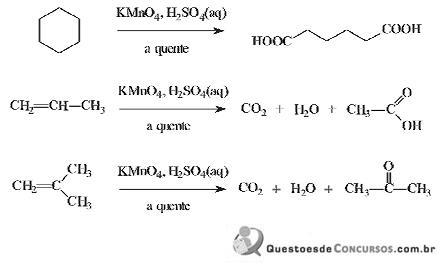
As amostras X, Y e Z são formadas por substâncias puras de fórmula
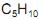 . Utilizando- se
. Utilizando- se 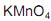 em meio de ácido sulfúrico a quente, foi realizada a oxidação enérgica de alíquotas de cada amostra. A substância X formou o ácido
em meio de ácido sulfúrico a quente, foi realizada a oxidação enérgica de alíquotas de cada amostra. A substância X formou o ácidopentanodióico, a substância Y gerou o ácido acético e a propanona, enquanto
que a substância Z produziu gás carbônico, água e ácido butanóico. As amostras X, Y e Z contêm, respectivamente,
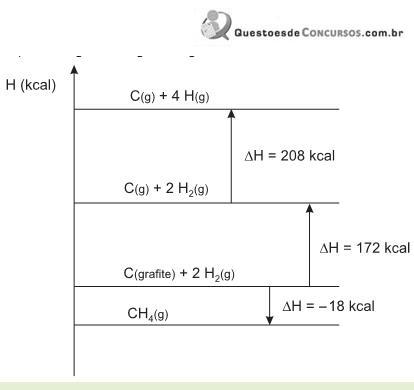
Os valores das energias de ligação H--H e C -- H obtidas a partir do diagrama são, respectivamente,
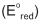
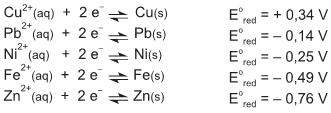
Em um estudo eletroquímico foram montadas 4 pilhas a partir de 4 pares redox distintos. Em todos os dispositivos o cátodo era constituído de uma solução aquosa de íons
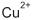 de concentração 1,0 mol/L e um eletrodo de cobre metálico. O ânodo era constituído de um metal ( M ), diferente em cada dispositivo,
de concentração 1,0 mol/L e um eletrodo de cobre metálico. O ânodo era constituído de um metal ( M ), diferente em cada dispositivo,imerso em solução do respectivo cátion
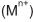 também de concentração 1,0mol/L.
também de concentração 1,0mol/L.A figura a seguir representa esquematicamente o aparato experimental.
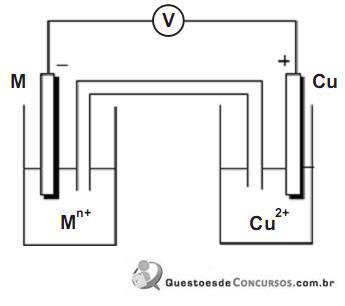
Os metais utilizados como ânodo foram zinco, níquel, chumbo e ferro. Em cada experimento foram determinadas a ddp inicial da pilha e a quantidade de carga gerada pela pilha durante a corrosão de 1,00 g do ânodo. Nestas condições, pode- se dizer que o ânodo cuja pilha apresenta a maior ddp e o ânodo cuja pilha gera a maior quantidade de carga são formados, respectivamente, pelos metais
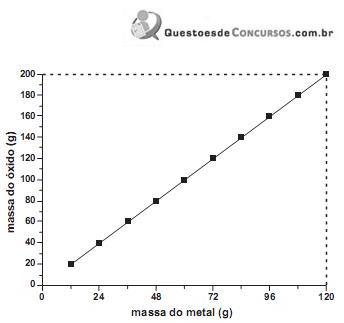
Durante um experimento, realizado em recipiente fechado, foi colocado para reagir 1,00 g do referido metal, obtendo-se 1,40 g do seu óxido. Considerando-se que todo o oxigênio presente no frasco foi consumido, pode-se determinar que a massa de oxigênio presente no sistema inicial é x . Em outro recipiente fechado, foram colocados 1,50 g do referido metal em contato com 1,20 g de oxigênio. Considerando que a reação ocorreu até o consumo total de pelo menos um dos reagentes, pode- se afirmar que amassa de óxido gerado é y . Sabendo que ometal emquestão forma apenas um cátion estável e considerando que em todas as reações o rendimento foi de 100 %, os valores de x e y são, respectivamente,
Um técnico de laboratório distraído preparou solições de carbonato de potássio (K2CO3),
hidróxido de sódio (NaOH) e de hidróxido de cálcio (Ca(OH)2), colocando- se em três frascos não rotulados ( frascos X, Y E Z ).
Para identificar as soluções, um aluno misturou, em três tubos de ensaio distintos,
amostras de cada frasco com solução aquosa de ácido clorídrico. Nada foi observado nas soluções dos frascos X e Z, mas ocorreu uma efervenscência no
tuboque continha a solução do frasco Y.
Em seguida, o aluno combinou, dois a dois, os conteúdos de cada frasco ( frasco X, Y e Z ) em tubos de ensaios limpos.
Observou que só houve formação de precipitado quando misturou as soluções dos frascos X e Y.
Assinale a alternativa que identifica corretamente o conteúdo dos frascos X, Y e Z.
