Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
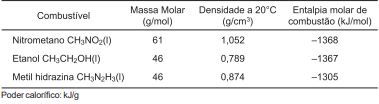
A tabela apresenta os valores de densidades, massa molar e entalpia molar de combustão de alguns combustíveis.
Considerando-se essas informações e com base nos conhecimentos de termoquímica, é correto afirmar:
Considerando-se essas informações, é correto afirmar:
Fe2+(aq) + HCO-3 + O2(aq) → Fe2O3(s) + CO2(g) + H2O(l)
A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
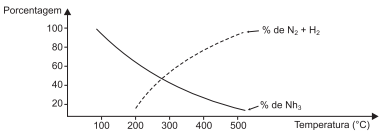
N2(g) + 3H2(g) 
O gráfico mostra a variação do rendimento de amônia com a
variação da temperatura de acordo com o sistema em equilíbrio
químico, a 100,0atm, representado pela equação termoquímica.
Uma análise desse gráfico e do sistema em equilíbrio químico representado pela equação termoquímica permite afirmar:
A partir da compreensão dessa informação, é correto afirmar:
(CoCl4) 2− (s) + 6H2O(l) [Co(H2O)6] 2+(aq) + 4Cl− (aq) ΔHº=−504kJ
As pequenas esferas azuis de sílica gel utilizadas como desumidificadores no transporte e na proteção de aparelhos eletroeletrônicos, em atmosfera úmida, absorve água do ambiente tornando-se cor de rosa. Ao serem aquecidas em uma estufa, voltam a ter a cor azul inicial de acordo com o sistema em equilíbrio químico representado pela equação química.
A análise desse sistema em equilíbrio químico e das
informações referidas no texto permite afirmar:
A partir dessas informações, é correto afirmar:
Com base nos conhecimentos dos modelos atômicos e nas propriedades periódicas dos elementos químicos, é correto afirmar:
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Para produzir 500 gramas de H2 pela reação representada na equação 3, a quantidade de metano consumida
será igual a
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Sobre as substâncias e as reações representadas por estas equações é incorreto afirmar que:
Disponível em < http://www.consciencia.net/2005/mês/10/taguchi-liebig.html> Acesso em: 1 nov. 2011.
Para suprir as necessidades das plantas por nitrogênio e potássio, podem ser utilizadas entre outras substâncias, o NaNO3 e o KCl.
Dadas as massas molares (g.mol-1): Na = 23, N = 14, O = 16, K = 39, Cl = 35,5
Estas substâncias apresentam em sua fórmula, respectivamente, teores de nitrogênio e potássio aproximadamente iguais a:
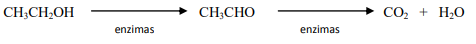
Disponível em: < http://qnesc.sbq.org.br/online/qnesc05/quimsoc.pdf > Acesso em: 1 nov. 2011 (adaptado).
Dadas as massas molares (g.mol-1): C = 12, H = 1, O = 16
De acordo com os seus conhecimentos de química é incorreto afirmar que:
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 6 H+ + 3SO42-
O excesso de íons H+ formado tende a diminuir o pH do meio, o que pode contribuir para a interrupção da formação do Al(OH)3, atrapalhando o processo de coagulação/floculação. Em alguns casos, o excesso de H+ é removido pela alcalinidade presente nas águas naturais. Se a alcalinidade do meio não for suficiente, o pH deve ser aumentado pela adição de outras substâncias. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf> Acesso em: 1 nov. 2011 (adaptado).
É possível aumentar o pH do meio aquoso adicionando-se a seguinte substância:
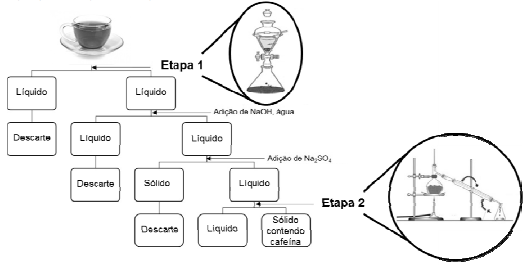
Um estudante foi ao laboratório e realizou uma série de experimentos para identificar um determinado composto químico. As observações sobre esse composto estão descritas abaixo:
Observação 1 - Possuía propriedades corrosivas.
Observação 2 - Possuía alta solubilidade em água.
Observação 3 - O papel de tornassol ficou vermelho em contato com ele.
Observação 4 - Apresentou condução de correte elétrica quando dissolvido em água.
Baseado nas observações feitas pelo estudante, pode-se afirmar que o composto analisado é: