Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
O livro “As Garotas da Cidade Atômica” (Denise Kiernan), lançado em 2015, aborda a presença de mulheres anônimas, que passaram despercebidas pela história, recrutadas em todos os Estados Unidos para trabalharem na cidade secreta de Oak Ridge em troca de bons salários. A cidade era sede do Projeto Manhattan, codinome de um plano criado para enriquecer urânio e criar bombas para uso bélico.
Eram secundaristas, químicas, estatísticas e secretárias, que pouco ou nada sabiam sobre o real propósito do que faziam e do misterioso projeto. A finalidade só foi divulgada ao mundo após o lançamento das bombas atômicas sobre Hiroshima e Nagasaki, no Japão, em agosto de 1945.
Uma das possíveis reações de fissão nuclear, que ocorre na explosão da bomba atômica está representada a seguir:
92U235 + 0 n1 → 56 Ba141 + 36Kr 92 + 3 X + energia
Na equação apresentada, X representa a:
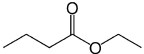
Sobre esse flavorizante, assinale a alternativa correta:
 Fonte da figura: http://www.foz.unioeste.br/~lamat/downmateriais/materiaiscap9.pdf
adaptada).
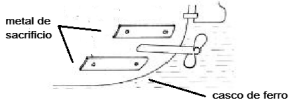
Fonte da figura: http://www.foz.unioeste.br/~lamat/downmateriais/materiaiscap9.pdf
adaptada). Considerando a equação de redução do ferro: Fe+2 + 2e- → Fe° Eº = - 0,44 V Assinale a alternativa que apresenta um metal de sacrifício que poderia ser usado nas plaquetas fixadas ao casco do navio, de forma a proteger o ferro da oxidação.
Substâncias Ponto de fusão (ºC) Ponto de ebulição (ºC) Pentano -130 36 Éter etílico -116 34
Assinale alternativa que apresenta a resposta correta para quando a temperatura registrada em Querência for de 34 ºC.
KMnO4 + H2O → MnO2 + O2 + KOH
A soma dos menores coeficientes estequiométricos inteiros da equação, quando balanceada, é:
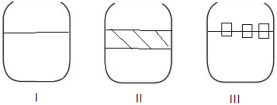
Sobre os 3 sistemas nos respectivos recipientes e suas possíveis combinações, são feitas algumas afirmativas. Assinale a correta.
O gás oxigênio é imprescindível para a vida dos seres vivos aeróbios. É o segundo gás mais abundante da atmosfera, e é pouco solúvel em água. Ademais, a sua diminuição por despejos de esgotos não tratados diretamente nos rios e córregos é preocupante por comprometer a fauna aquática.
Sobre o gás oxigênio, são feitas abaixo algumas afirmações. Assinale a correta.
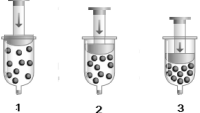
(Fonte Figura: Santos e Mól – Quimica Cidadã- 1ª série Editora AJS-SP(2011)).
Admitindo que o experimento tenha sido realizado em temperatura constante, pode-se afirmar que o gráfico que representa a transformação gasosa acima é:
A história de contaminações por metais (rejeitos) das águas dos rios em Minas Gerais é antiga. Segundo informações de pesquisa da Unicamp, há 15 anos, o arsênio no solo e na água utilizada por moradores do Quadrilátero Ferrífero estaria relacionado à intensa mineração de ouro, explorada nos últimos 300 anos.
O arsênio está entre os metais mais nocivos à saúde humana. Quantidades elevadas (acima de 10-5 gramas por litro de água potável) podem provocar vários tipos de cânceres, além de abalos ao sistema nervoso, malformação neurológica e abortos.
(Fonte: Isabel Gardenal, Jornal da Unicamp, novembro de 2002.)
Sobre o arsênio e as informações apresentadas são feitas algumas afirmações. Assinale a correta:
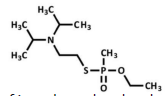
Pode-se afirmar que a fórmula molecular do agente VX é:
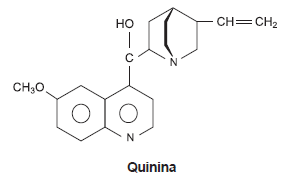
A quinina, um alcaloide representado pela fórmula estrutural e utilizado no tratamento da malária sob forma de sulfato, é extraída da Chinchona ledgeriana, um arbusto da família das rubiáceas, originado dos Andes.
Considerando-se essas informações sobre a quinina, é correto afirmar:
Considerando-se a problemática do lixo das grandes regiões metropolitanas do país, dentre as soluções corretas para reduzir o acúmulo desse material nos aterros sanitários, pode-se incluir
COOH
Ácido Cítrico
O ácido cítrico, responsável pela acidez das frutas cítricas, é utilizado como acidificante e flavorizante no processamento de alguns alimentos.
A partir dessas informações, é correto afirmar:
Ácido Halogenídrico Constante de ionização, Ka, a 25º C
HF (aq) 6,0.10-4
HC (aq) 1,0.107
HBr (aq) 1,0.109
HI (aq) 3,0.109
A tabela relaciona os valores da constante de ionização, Ka, dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
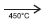 2HI(g) v = k[H2] [I2]
2HI(g) v = k[H2] [I2] O modelo da teoria das colisões, que resultou de estudos dos fatores que influem na velocidade das reações químicas, é uma explicação para o modo como as moléculas de reagentes são clivadas e são formadas as moléculas de produtos de uma reação química.
Admitindo-se a reação química elementar entre o hidrogênio e o iodo, a 450oC, representada pela equação química, a expressão da lei de velocidade dessa reação, e com base na teoria das colisões, para que essa reação ocorra, dentre outros fatores, é preciso que
I. NO(g) + 1/2 O2(g) → NO2(g) + 56.7kJ
II. 1/2 N2(g) + O2(g) → NO2(g) + 38,8Kj
III. 1/2 N2(g) + 1/2 O2(g) → NO(g)
De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:
I. CaC2(s) + N2(g) 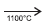 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
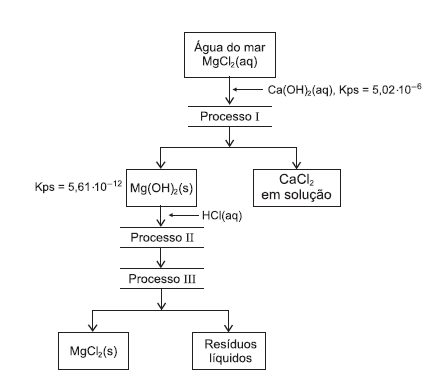
No processo Dow, de extração de magnésio, da água do mar, sob a forma de íons Mg2+(aq), representado pelo fluxograma, hidróxido de cálcio, Ca(OH)2(aq), é adicionado à água do mar, para que o Mg(OH)2(s) se precipite, permanecendo os íons Ca2+(aq) na fase aquosa. Após precipitação do cloreto de magnésio, MgCl2(s), produto final desse processo, esse sal é utilizado para produzir magnésio por eletrólise.
A partir da análise desse fluxograma e das informações do
texto, é correto afirmar:
