Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 888 questões
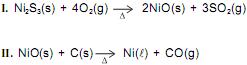
Um dos processos de obtenção do níquel, metal utilizado na fabricação de moedas, consiste, inicialmente, no aquecimento de sulfeto de níquel(III) na presença de ar. Durante esse processo, são formados óxido de níquel(II) e de dióxido de enxofre, de acordo com a equação química I, e, posteriormente, o NiO(s) reage com o carvão, em forno siderúrgico, com obtenção do níquel metálico e do monóxido de carbono, conforme reação representada na equação química II.
Considerando-se as informações do texto e as equações químicas I e II que representam, resumidamente, esse processo, é correto afirmar:
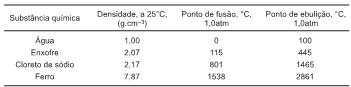
As substâncias químicas têm propriedades bem definidas e, eventualmente, duas substâncias diferentes podem possuir algumas propriedades iguais, mas não todas elas.
Considerando-se essas informações e os dados da tabela que representa algumas propriedades de substâncias químicas, é correto afirmar:
O índice de saponificação de uma amostra de óleo de macaúba, formada apenas por triglicerídeos, corresponde a 168,3 mg de KOH por g do óleo. Considerando uma completa saponificação, calcule, em gramas por mol, a massa molar média das moléculas do óleo dessa amostra. Divida o resultado encontrado por 2. Para a marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado final obtido, após ter efetuado todos os cálculos solicitados.
Considere que a análise das cinzas geradas pela queima da casca do fruto de macaúba tenha evidenciado a presença de 0,040 g de óxido de sódio e 0,044 g de óxido de magnésio. Nesse caso, a massa de sódio presente na casca analisada é superior à massa de magnésio.
causou a contaminação da água da região com iodo-131, um
material radioativo. O iodo é a matéria-prima principal que a
glândula tireoide utiliza para a formação de seus hormônios. A
exposição da glândula a altas concentrações desse isótopo pode
levar ao desenvolvimento de nódulos e de câncer da tireoide.
Mulheres grávidas, as que amamentam, fetos, bebês e crianças
constituem a população de maior risco, conforme demonstrado pela
experiência do acidente nuclear de Chernobyl. Para mitigar os
riscos de contaminação, o governo orientou os residentes de áreas
afetadas a ingerir, de forma profilática, iodeto de potássio (KI),
porque o organismo saturado com iodo estável não absorve o
radioativo.
Com relação ao tema acima, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.
Quantos elétrons são produzidos a partir da oxidação de 460 μg de etanol no interior de um bafômetro informado no texto acima.?
Dado: número de Avogrado: 6.1023 CH3CH2OH = 46 g/mol
Fonte: http://g1.globo.com
O esquema abaixo mostra a produção de álcool etílico a partir da cana de açúcar.
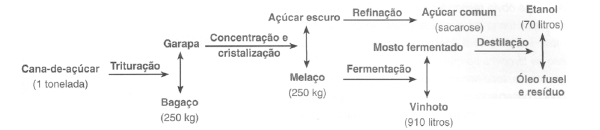
A partir dos dados informados, é possível concluir que, no período de 2011/2012, a quantidade de cana de açúcar usada para produzir o etanol será a seguinte:
2 NaOH(aq) + Cl2(g) → NaClO(aq) + NaCl(aq) + H2O(l)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:
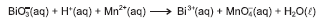
No balanceamento das equações de oxirredução, o fundamental é identificar o número de elétrons recebidos e cedidos, o número total de átomos de cada elemento químico no primeiro e segundo membros da equação química, além do total de carga elétrica em cada um de seus membros. Assim, com base nessas considerações, e a partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
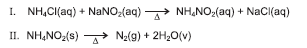
As bolinhas de tênis são feitas basicamente de borracha. Na primeira etapa de fabricação, a borracha é prensada em moldes de ferro e ganha forma de uma concha. Antes de as duas metades da bolinha serem coladas, coloca-se, no interior de uma delas, nitrito de amônia, que é obtido de acordo com a equação química I. Na etapa seguinte, as duas conchas são unidas por cola especial e, em seguida, prensadas a 200° C. Com o aquecimento, durante o processo de colagem, o nitrito de amônia se decompõe, de acordo com a equação química II, em nitrogênio, que exerce pressão no interior da bolinha. Admitindo-se que o volume da bolinha de tênis, a 25° C, é 140,0mL, que o volume de água produzido no seu interior é desprezível, é correto, a partir das informações do texto e das equações químicas I e II , afirmar:
Os CFCs, utilizados como propelentes em sprays, ao atingirem a estratosfera, se decompõem sobre ação da radiação ultravioleta. Durante esse processo, átomos livres de cloro são formados e, ao reagirem com ozônio, O3(g), de acordo com a equação química, resumida, provocam a redução da concentração desse gás, diminuindo, assim, a proteção do planeta contra radiações ultravioleta.
Considerando-se essas informações, é correto afirmar:
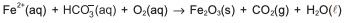
A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:

