Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 888 questões
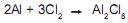
Pode-se afirmar que o reagente limitante, quando 20,0 g de Al e 30,0 g de Cl 2 são usados, e a massa em grama de cloreto de alumínio, teoricamente formada, são, respectivamente,
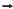 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Com base nesses dados, calcula-se que a massa, em gramas, de gás carbônico liberado para o ar pela reação foi igual a
Ca10(PO4)6OH2(s)+H+ (aq) ↔Ca2+ (aq)+HPO4 2– (aq)+ H2O(l)
A reação direta, que enfraquece o esmalte e produz a cárie, é conhecida como desmineralização, e a reação inversa como mineralização.
Sobre o sistema acima indicado, assinale a afirmação FALSA.
Assinale a alternativa que mostra corretamente a provável estrutura do óxido nitroso.
Considere que um atleta com M kg de massa, partindo do repouso, comece a correr com aceleração constante de a m/s² ; que, enquanto corre, o atleta sofre a ação de uma força de resistência constante igual a R newtons; que toda a energia do atleta resulta da oxidação de gordura, a qual é representada pela expressão a seguir, em que E é a energia, em joules, liberada por mol de gordura.
C3H5O3(OC4H7)3 + 18,502 ? 15CO2 + 13H2O + E
Supondo-se que a eficiência do atleta seja 0, então a expressão matemática que representa a quantidade de moles N de gás carbônico produzido pelo atleta até o tempo t, em segundos, transcorrido desde o momento em que ele iniciou a corrida, é
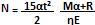
Considere que uma pessoa que pese 60 kg tenha subido, com velocidade constante, uma ladeira de 30° de inclinação, mantendo uma respiração que consome 0,78 L de O2 por minuto. Nesse caso, se toda a produção de energia interna vier da oxidação de glicose, então essa pessoa terá caminhado, em uma hora, menos de 3,5 km.
A massa molar da fórmula molecular mínima do ibuprofeno é 220,0 g/mol.
Considere que o ar atmosférico seja uma mistura de gases e tenha a composição mostrada na tabela abaixo. Sabendo-se que a massa molar aparente desse ar é a média ponderada que relaciona a fração em volume de cada componente com a sua respectiva massa molar e assumindo-se a constante universal dos gases R = 0,082 atm·L/KAmol, é correto afirmar que, a 1 atm e a 0 ºC, a densidade aparente desse ar é superior a 1,25 g/L.
Questão Discursiva
Em um frasco de 1,0 L, foram colocados, a determinada temperatura, 0,880 g de N2O e 1,760 g de O2 gasosos, para reagir. Após se estabelecer o equilíbrio químico, foi formado 1,012 g de gás NO2. Considerando essas condições, calcule a concentração molar de equilíbrio do O2 e multiplique o resultado por 104 . Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado obtido, após ter efetuado todos os cálculos solicitados.
R:385
O percentual em massa de nitrogênio presente em todo o explosivo usado para demolir a arquibancada do estádio Mané Garrincha foi de
Após se balancear a equação xNH3 + yO2 ? zN2 + wH2O — que representa a combustão da amônia — usando-se os menores valores inteiros positivos para seus coeficientes estequiométricos, verifica-se que o resultado da soma x + y + z + w é um múltiplo inteiro de 5.
Considerando-se o rendimento de 100% para a reação de combustão do nitrato de amônio, é correto afirmar que a quantidade de explosivo utilizada na referida demolição da arquibancada do estádio Mané Garrincha produziu mais de 9,0 × 105 kJ de energia.
Com relação a essas substâncias, assinale a afirmação correta.
30 60
50 70
Para dissolver 40 g desse sal à 50 °C e 30 °C, as massas de água necessárias, respectivamente, são:
I. K2S(aq.) + 2 HCℓO3(aq.) → 2 KCℓO3(aq.) + H2S(aq.)
II. Zn(OH) 2(s) → ZnO(s) + H2O(ℓ)
III. Cℓ2(g) + 2 HI(aq.) → I2(s) + 2 HCℓ(aq.)
A classificação da reação equacionada e o nome do composto em negrito são respectivamente:
I. Cu(OH)2 + H4P2O7-> Cu2P2O7 + H2O
II. H2S + O2 -> H2O + S8
III. Aℓ(OH)3 + H4SiO4 -> Aℓ4 (SiO4)3 + H2O
Assinale a alternativa que mostra corretamente os coeficientes estequiométricos das reações I, II e III.
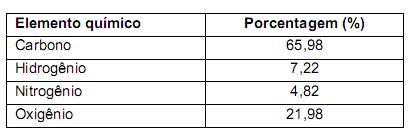
De acordo com as informações acima, os valores de x e y são, respectivamente,




